Написать структурную формулу пропилена, над атомами углерода, указать типы гибридизации электронных орбиталей и объяснить, сколько орбиталей типа S 1p, Sp2, Sp3 образуют молекулу пропилена.
Решение: Обозначим у каждого атома углерода его валентное состояние – тип гибридизации электронных орбиталей.
Sp2 Sp2 Sp3
СН2 = СН – СН3
1 2 3
Орбитали типа Sp2 образуют первый и второй углеродный атом, т.е. их 3 * 2 = 6. Первый и второй атом углерода содержит еще по одной р – орбитали, которые образуют 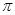 - связь, их всего 2. Третий углеродный атом находиться в состоянии Sp3 – гибридизации.
- связь, их всего 2. Третий углеродный атом находиться в состоянии Sp3 – гибридизации.
Следовательно, орбиталей Sp3 всего 4. Так, количество орбиталей в молекуле пропилена:
Sp3 – орбитали - 4
Sp2 – орбитали - 6
S – орбитали - 6
р – орбитали – 2
Sp – гибридизация – смещение одной S – орбитали и одной р – орбитали, образуется две гибридные орбитали.
| |||||||||
 |  |  |  | ||||||
| 2S | 2рх | 2ру | 2рz |

(Sp)2
В молекуле ацетилена оба атома углерода находятся в состоянии Sp – гибридизации.
Sp Sp
СН = СН
Каждый атом углерода имеет по две гибридные орбитали и по две негибридизованные р – орбитали, т.е. в образовании молекулы ацетилена участвуют:
Sp – орбитали – 2 * 2 = 4
S – орбитали – 1 * 2 = 2
р – орбитали – 2 * 2 = 4
 2015-03-07
2015-03-07 1079
1079








