Из уравнения Гиббса – Гельмгольца:
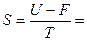
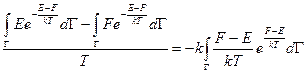 .
.
Обозначим 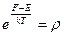 ;
; 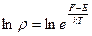 , и, т. к. функция распределения
, и, т. к. функция распределения 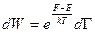 , используем выражение для среднего:
, используем выражение для среднего:
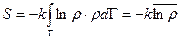 .
.
Записанное выражение отражает статистический смысл энтропии. Энтропия прямо пропорциональна среднему значению логарифма функции распределения.
Анализируя статистический смысл энтропии, рассмотрим следующий пример.
Допустим, есть два объема: 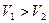 , причем в объемах содержится одинаковое количество молекул
, причем в объемах содержится одинаковое количество молекул 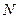 .
.
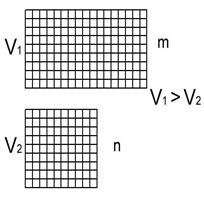
Введем достаточно маленький объемчик 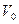 и разобьем
и разобьем 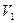 и
и 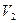 на такие элементарные объемы.
на такие элементарные объемы.
В первом случае получим 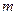 -ячеек, во втором
-ячеек, во втором 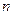 -ячеек. Одну молекулу можно распределить
-ячеек. Одну молекулу можно распределить 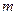 -способами в
-способами в 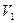 и
и 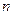 -способами в
-способами в 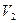 .
.
Тогда в первом случае: 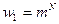 , во втором:
, во втором: 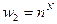 .
.
Найдем отношение 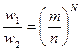 .
.
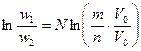 ,
,
(2) 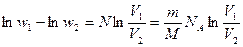 .
.
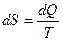 .
.
Рассмотрим переход газа при изотермическом процессе от 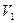 до
до 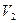 :
:
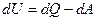 (первый закон термодинамики).
(первый закон термодинамики).
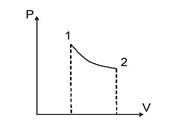
В изотермическом процессе 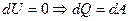 ,
,
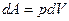 ,
,
Из уравнения Менделеева: 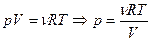 ,
,
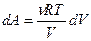 ,
,
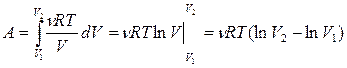 ,
,
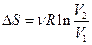 .
.
Чтобы было соответствие с рисунком, переобозначим точки:
(3) 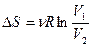 .
.
Сравним (2) и (3).
Домножим обе части (2) на 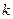 :
:
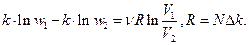
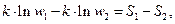

Энтропия пропорциональна числу возможных способов размещения в объеме.
Число возможных различных состояний 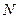 будем называть термодинамической вероятностью.
будем называть термодинамической вероятностью.
 2015-03-27
2015-03-27 321
321








