Пример 1. Сколько грамм NaCl необходимо взять, чтобы приготовить 1 литр раствора с концентрацией Na 1 г/л.
Для решения подобной задачи, необходимо составить пропорцию используя молярные массы веществ;
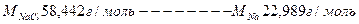
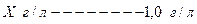
Исходя из пропорции получаем;
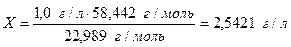
Соответственно, чтобы получить концентрацию Na+ 1,0 г/л, необходимо взять навеску массой 2,5421 г. и растворить в 1 л. воды.
Зная молярную масс и количество вещества, можно найти число моль вещества в 1 л раствора:
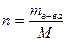
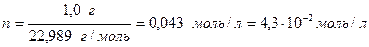
Пример 2. Сколько мл такого раствора (концентрация 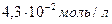 ) надо взять, чтобы при разбавлении в колбе на 250 мл он содержал
) надо взять, чтобы при разбавлении в колбе на 250 мл он содержал 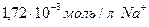
По формуле: 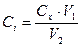
где: 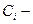 полученная концентрация после разбавления;
полученная концентрация после разбавления; 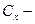 исходная концентрация;
исходная концентрация; 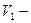 объем пипетки;
объем пипетки; 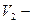 объем мерной колбы.
объем мерной колбы.
Так как мы ищем объем, получаем; 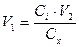
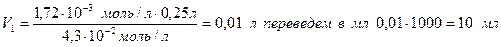
Таким образом, чтобы получить раствор с концентрацией 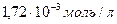 в колбе на 250 мл, необходимо взять исходного раствора (
в колбе на 250 мл, необходимо взять исходного раствора (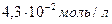 ) 10 мл.
) 10 мл.
Пример 3. Найти минимальную концентрацию, для фотоколориметрии при определении палладия (II) с диметилглиоксимом. Молярный коэффициент светопогащения палладия с диметилглиоксимом 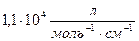
Решение по формуле 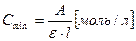
где: А – минимальная оптическая плотность для фотоколориметров (она составляет 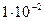 ),
), 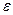 - молярный коэффициент светопогашения
- молярный коэффициент светопогашения 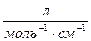 , l – длина кюветы, см.
, l – длина кюветы, см.
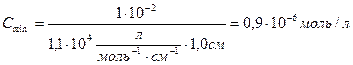
Итак, минимальная концентрация для фотоколориметра, которую можно определить составляет 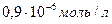
Задачи
Задача 1. Сколько грамм вещества надо взять (2 столбик), чтобы приготовить раствор с концентрацией моль/л элемента (3 столбик) для спектрометрии.
Задача 2. Сколько мл, такого раствора надо взять, чтобы при разбавлении в колбе на 50 мл он содержал заданную концентрацию. Результаты выразить в г/л и в моль/л вещества.
| № | Название вещества | С, моль/л | Определя-емый элемент | С, моль/л | ||||
| KAl(SO4)2∙12H2O | 0,037 | Al3+ | 0,74∙10-3 | 0,22∙10-2 | 0,37∙10-2 | 0,40∙10-2 | 0,59∙10-2 | |
| KAl(SO4)2∙12H2O | 0,018 | Al3+ | 0,37∙10-3 | 0,14∙10-2 | 0,29∙10-2 | 0,55∙10-2 | 0,74∙10-2 | |
| KAl(SO4)2∙12H2O | 0,007 | Al3+ | 0,14∙10-2 | 0,22∙10-2 | 0,29∙10-2 | 0,37∙10-2 | 0,59∙10-2 | |
| KAl(SO4)2∙12H2O | 0,009 | Al3+ | 0,18∙10-3 | 0,37∙10-3 | 0,12∙10-2 | 0,27∙10-2 | 0,37∙10-2 | |
| SiO2 | 0,0035 | Si4+ | 0,70∙10-4 | 0,28∙10-3 | 0,35∙10-3 | 0,71∙10-3 | 1∙10-3 | |
| CdCl2 | 0,0088 | Cd2+ | 0,17∙10-3 | 0,88∙10-3 | 0,17∙10-2 | 0,26∙10-2 | 0,35∙10-2 | |
| CuSO4∙5H2O | 0,015 | Cu2+ | 0,63∙10-3 | 0,15∙10-2 | 0,47∙10-2 | 0,62∙10-2 | 0,78∙10-2 | |
| CuSO4∙5H2O | 0,0015 | Cu2+ | 0,31∙10-4 | 0,12∙10-3 | 0,40∙10-3 | 0,60∙10-3 | 0,62∙10-3 | |
| CuSO4∙5H2O | 0,007 | Cu2+ | 0,78∙10-3 | 0,15∙10-2 | 0,13∙10-2 | 0,31∙10-2 | 0,39∙10-2 | |
| FeNH4(SO4)2∙12H2O | 0,018 | Fe2+ | 0,35∙10-3 | 0,71∙10-3 | 0,17∙10-2 | 0,35∙10-2 | 0,53∙10-2 | |
| FeNH4(SO4)2∙12H2O | 0,0035 | Fe2+ | 0,14∙10-3 | 0,71∙10-3 | 0,1∙10-2 | 0,14∙10-2 | 0,18∙10-2 | |
| FeSO4∙(NH4)2SO4∙12H2O | 0,018 | Fe2+ | 0,14∙10-2 | 0,21∙10-2 | 0,28∙10-2 | 0,42∙10-2 | 0,64∙10-2 | |
| KMnO4 | 0,018 | Mn7+ | 0,36∙10-3 | 0,72∙10-3 | 0,18∙10-2 | 0,36∙10-2 | 0,54∙10-2 | |
| MnSO4 | 0,018 | Mn2+ | 0,14∙10-2 | 0,22∙10-2 | 0,29∙10-2 | 0,43∙10-3 | 0,65∙10-2 | |
| MnSO4 | 0,0036 | Mn2+ | 0,36∙10-3 | 0,72∙10-3 | 0,11∙10-2 | 0,14∙10-2 | 0,18∙10-2 | |
| (NH4)2 NiSO4∙6H2O | 0,017 | Ni2+ | 0,34∙10-3 | 0,68∙10-3 | 0,13∙10-2 | 0,20∙10-2 | 0,27∙10-2 | |
| NiSO4 | 0,017 | Ni2+ | 0,17∙10-2 | 0,40∙10-2 | 0,51∙10-2 | 0,68∙10-2 | 0,85∙10-2 | |
| Pb(NO3)2 | 0,0048 | Pb2+ | 0,96∙10-4 | 0,48∙10-3 | 0,11∙10-2 | 0,14∙10-2 | 0,24∙10-2 | |
| ZnSO4∙7H2O | 0,015 | Zn2+ | 0,61∙10-3 | 0,30∙10-2 | 0,45∙10-2 | 0,61∙10-2 | 0,76∙10-2 | |
| SeO2 | 0,012 | Se4+ | 0,25∙10-3 | 0,50∙10-3 | 0,10∙10-2 | 0,15∙10-2 | 0,25∙10-2 | |
| K2SO4 | 0,031 | S6+ | 0,62∙10-3 | 0,12∙10-2 | 0,31∙10-2 | 0,62∙10-2 | 0,93∙10-2 | |
| Sn | 0,0084 | Sn2+ | 0,16∙10-3 | 0,34∙10-3 | 0,84∙10-3 | 0,17∙10-2 | 0,25∙10-2 | |
| Sn | 0,0042 | Sn2+ | 0,84∙10-4 | 0,17∙10-3 | 0,42∙10-3 | 0,84∙10-3 | 0,25∙10-3 | |
| H4TiO4 | 0,021 | Ti4+ | 0,42∙10-3 | 0,83∙10-3 | 0,21∙10-2 | 0,42∙10-2 | 0,62∙10-2 | |
| KH2PO4 | 0,064 | P5+ | 0,13∙10-3 | 0,26∙10-3 | 0,64∙10-3 | 0,13∙10-2 | 0,26∙10-2 |
Задача 3. Молярный коэффициент поглощения комплекса в растворе при длине волны составляет см. табл. Кювета 1 см, Аmin=0,01. Рассчитать минимальную концентрацию, которую можно определить.
| № | Элемент | Комплекс | ε л∙моль-1∙см-1 | λ, нм |
| Al3+ | Алюминон | |||
| Al3+ | Ксиленоловый оранжевый | |||
| Al3+ | 8-Оксихинолин | |||
| Al3+ | Эриохромцианин | |||
| Si4+ | Молибдат аммония | |||
| Cd2+ | Дитизон | |||
| Cu2+ | Дитизон | |||
| Cu2+ | Диэтилдитиокарбомат | |||
| Cu2+ | Аммиак | |||
| Fe2+ | αα-дипиридил | |||
| Fe2+ | 1.10 фенантролин | |||
| Fe2+ | Сульфосалициловая кислота | |||
| Mn7+ | Сульфосалициловая (желт. комплекс) | |||
| Mn2+ | Персульфат аммония | |||
| Mn2+ | Формальдоксим | |||
| Ni2+ | Диэтилдитиокарбомат | |||
| Ni2+ | Диметилглиоксим | |||
| Pb2+ | α-фурилдиоксим | |||
| Zn2+ | α-фурилдиоксим | |||
| Se4+ | Дитизон | |||
| S6+ | Дитизон | |||
| Sn2+ | 3.3. диаминобензидин | |||
| Sn2+ | Метиленовый голубой | |||
| Ti4+ | Фенилфлуорон | |||
| P5+ | Дитиол |
 2015-03-27
2015-03-27 1149
1149








