Запишем первый закон термодинамики в виде:
dQ = dU + dL.
Знаки теплоты и изменения внутренней энергии весьма условны. Будем считать подводимую к системе теплоту положительной, а отводимую – отрицательной, хотя часто в литературе, особенно по химии, приняты обратные знаки.
Перепишем уравнение в виде
– dU = – dQ + dL,
то есть убыль внутренней энергии равна сумме выделившегося тепла и работы.
Работа
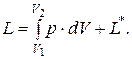
В величину работы входит не только работа расширения, но и работа  в результате действия электрических, световых и других сил, которые могут проявляться в результате химической реакции.
в результате действия электрических, световых и других сил, которые могут проявляться в результате химической реакции.
Изменение внутренней энергии может распределяться между теплотой и работой различным образом. Возможны крайние случаи, когда:
а) максимум внутренней энергии превращается в работу
– D U = – Q min+ L max;
б) в реакциях, кроме работы расширения, другой работы не производится
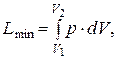
в этом случае имеем
– D U = – Q max + L min.
В первом случае реакция протекает в условиях полной обратимости, а во втором – она необратима.
 2015-03-07
2015-03-07 597
597








