1. Собрать установку изображенную на рисунке:
1. Катод.
2. Анод.
3. электролит – раствор ZnSO4
4. электролит – раствор CuSO4
5. Электролитический мостик
с раствором КСl.
6. милливольтметр.
2. Произвести замер величины ЭДС гальванических элементов. Данные измерений занести в таблицу.
(-) Zn| ZnSO4 1M || CuSO4 1M | Cu (+)
(-) Zn| ZnSO4 1M || CuSO4 0,01M | Cu (+)
(-) Zn| ZnSO4 0,01M || CuSO4 1M | Cu (+)
(-) Zn| ZnSO4 0,01M || CuSO4 0,01M | Cu (+)
3. Рассчитать величину ЭДС по уравнению Нернста для всех 4-х модификаций гальванического элемента, рассчитанные величины записать в таблицу.
E1=
E2=
E3=
E4=
4.Вычислить абсолютную погрешность измерений 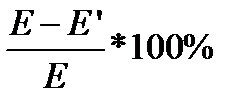 E-ЭДС, рассчитанная по уравнению Нернста
E-ЭДС, рассчитанная по уравнению Нернста
| № | Анод | Катод | ZnSO4, моль/л | CuSO4, моль/л | Е1, вольт | Е, вольт | % Погрешность |
Для определения активности ионов в растворе электролита: аМ е= fMe· CMe
• аМ е – активность ионов в растворе (моль/л);
• fMe - коэффициент активности ионов в растворе данной концентрации;
• CMe - молярная концентрация потенциалопределяющего иона в растворе электролита (моль/л).
| раствор CuSO4 | раствор ZnSO4 | ||
| CMCu2+ | f Cu2+ | CMZn2+ | f Zn2+ |
| 1,0 | 0,043 | 1,0 | 0,043 |
| 0,01 | 0,438 | 0,01 | 0,387 |
Вывод:
Опыт № 2. Электролиз водного раствора (CuI2) CuCl2
 2015-03-07
2015-03-07 368
368








