Основным законом химической кинетики является открытый норвежскими учеными математиком Гульдбергом и химиком Вааге (1867 г.) закон действующих масс, согласно которому скорость химической реакции пропорциональна произведению концентраций реагирующих веществ возведенных в степени их стехиометрических коэффициентов.
(К.Гульдберг и П.Вааге называли «действующей массой» - массу вещества в единице объема, отсюда название закона. Современный термин концентрация ввел Вант – Гофф). Для двумолекулярной реакции, протекающей в гомогенной среде, вида
m A + n B = p C +  q D;
q D;
скорости прямой и обратной реакций выразятся следующими кинетическими уравнениями:
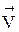 = k1 · CAm · CBn
= k1 · CAm · CBn
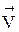 = k2 · CСp · CDq,
= k2 · CСp · CDq,
где: СА, Св, Сс и СD – концентрации реагентов А, В
и продуктов С и D – моль/л
m, n,p,q – стехиометрические коэффициенты
k – коэффициент пропорциональности, который называется константой скорости.
Кинетическим уравнением называется уравнение, связывающее скорость реакции с концентрацией реагирующих веществ.
Константа скорости – это скорость реакции при концентрациях реагирующих веществ, равных 1 моль/л, зависит от природы реагирующих веществ и температуры, но не зависит от концентрации.
 2015-03-08
2015-03-08 390
390