Сущность первого закона термодинамики. Принцип эквивалентности тепла и работы.
Первый закон термодинамики является частным случаем всеобщего закона сохранения энергии в применении к тепловым процессам, он утверждает что: Тепло может быть превращено в работу и наоборот.
Всегда определенное количество работы эквивалентно определенному количеству тепла.
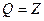 - принцип эквивалентности.
- принцип эквивалентности.
Q – количество тепла превращенного в работу.
Z – количество работы, полученной за счет тепла.
Следствие отмеченного принципа – невозможность вечного двигателя первого рода.
Невозможно создать такой непрерывно работающий двигатель, который бы не нуждался в непрерывном подводе энергии.
Все виды энергии измеряются в джоулях.
1 джоуль тепла – это тепло полученное при совершении 1 джоуля работы.
1.5.1. Уравнение первого закона термодинамики.
- является математическим выражением принципа эквивалентности тепловой и механической энергии с учетом изменения внутренней энергии рабочего тела.
Процесс совершается массой М [ кг ].
При подводе тепла Q [ дж ] рабочее тело:
1) Нагревается, на что расходуется U2-U1 тепла. U2; U1 – внутренняя энергия рабочего тела.
2) Расширяется, совершая внешнюю работу L [дж].
Этим исчерпываются все возможные превращения тепла.
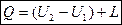
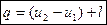 - в удельных величинах.
- в удельных величинах.
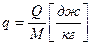
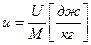
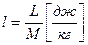
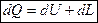 - основное уравнение первого закона термодинамики.
- основное уравнение первого закона термодинамики.
В любом процессе подведенное к рабочему телу тепло расходуется на изменение внутренней энергии и на совершение внешней работы.
Это уравнение применимо для всех процессов.
+L – при расширении
-L – при сжатии
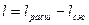
+Q – при подводе тепла к рабочему телу.
-Q – при отводе тепла от рабочего тела.
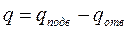
Если рабочее тело приходит в исходное состояние, то
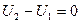 и
и 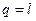 - частный случай.
- частный случай.
Внутренняя энергия газа.
Складывается из кинетической энергии молекулярного движения, внутрисистемного, внутриядерного и т.д., и из потенциальной энергии взаимодействия микрочастиц.
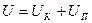 , для идеального газа
, для идеального газа 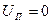
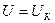
В термодинамике рассматриваются макро свойства:
1. По определению внутренняя энергия есть параметр состояния рабочего тела.
2. Внутренняя энергия есть величина. энергия отдельных частей тела может складываться, т.е.
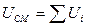
3. При элементарном изменении состояния 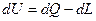 , где dU – полный дифференциал, т.к. линейный интеграл по замкнутому контуру равен нулю.
, где dU – полный дифференциал, т.к. линейный интеграл по замкнутому контуру равен нулю.
4. В расчетах используется не абсолютное значение U, а разность (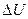 ), поэтому за начало отсчета принято
), поэтому за начало отсчета принято 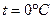
Из первого закона термодинамики 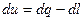
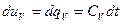 - при V=const
- при V=const
Для идеального газа dU пишется без индекса “V”
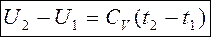 - в конечном процессе для идеального газа.
- в конечном процессе для идеального газа.
С учетом этого уравнение первого закона термодинамики запишется:
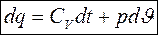 - для идеального газа.
- для идеального газа.
С учетом зависимости 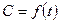 :
:
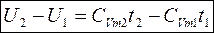
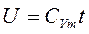 При t=0 U=0
При t=0 U=0
Внешняя работа газа в равновесном процессе.
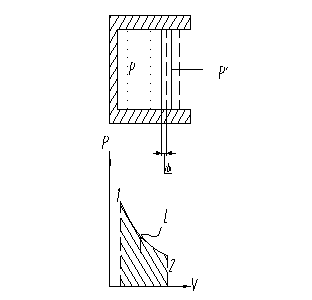
Утечек и трения нет.
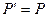 - в равновесном процессе.
- в равновесном процессе.
При расширении будет совершенна работа: 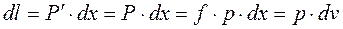
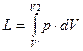 - для конечного процесса.
- для конечного процесса.
Т=0 градусы Кельвина К – абсолютный уровень отсчета.
Пример.
Определить изменение внутренней энергии 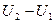 , для двух кг. кислорода О2 при нагревании его от t1=200C;до t2=1800C, считать теплоёмкость С=const.
, для двух кг. кислорода О2 при нагревании его от t1=200C;до t2=1800C, считать теплоёмкость С=const.
Молярная теплоёмкость 20,9 кдж/моль.
 2015-03-07
2015-03-07 691
691








