Компонентами в сплавах железа с углеродом являются металл железо и неметалл углерод.
В промышленности чистое железо практически не используется, а наиболее широко применяются его сплавы. Основными из них являются сплавы железа с углеродом называемые сталями и чугунами.
Диаграмма состояний сплавов в системе железо - углерод дает первостепенные представления и понятия о строении и свойствах их составляющих.
Наибольшее практическое значение имеет только часть диаграммы состояния железо-углерод, в которой показано формирование цементита Fe3C, так как сплавы, содержащие большее количество углерода, очень хрупкие и практически не применяются в промышленности. Поэтому диаграмму состояния системы железо-углерод изображают только до концентрации углерода 6,67 % масс и называют диаграммой состояний железо-цементит
Железо – химический элемент IV периода VIII группы периодической системы элементов Д. И. Менделеева. Химический знак Fe, атомный номер 26, радиус 0,127 нм, масса 55,85, металл.
Железо является одним из наиболее распространенных элементов в природе, уступая лишь кислороду, кремнию и алюминию. Общее его содержание в земной коре составляет 5,1 %. В свободном виде оно находится в падающих на землю метеоритах. Распространены в природе различные соединения железа. Оно входит в состав большинства горных пород и минералов, из которых состоят месторождения железных руд.
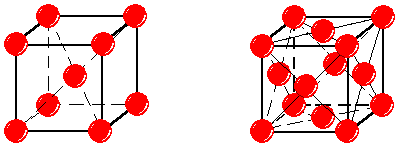 |
Чистое железо (Fe) имеет температуру плавления 1539ºC, плотность –7,68 - 7,85 г/см3. Металл обладает невысокой твердостью и прочностью НВ» 80, sв» 250 МПа; s0,2 = 120 МПа и хорошей пластичностью; d = 50 %; y = 80 %. В твердом состоянии испытывает два полиморфных превращения. Важнейшее из них – превращение при 911ºC. Ниже этой температуры железо имеет объемно-центрированную кубическую решетку (ОЦК) с параметром a = 0,286 нм (рис.1, а). Это α-железо (Feα). Выше 911ºC существует γ-железо (Feγ) с гранецентрированной кубической решеткой (ГЦК) и параметром a = 0,364 нм (рис.1, б).
а б
Рис. 1. Кристаллическая решетка a-железа (а) и g-железа (б)
α-железо ферро магнитно, При 768°С у него исчезают ферро магнитные свойства и железо становится парамагнитным, но кристаллическая структура его существенно не меняется. Критическую точку, соответствующую магнитному превращению, т. е. переходу из ферромагнитного состояния в парамагнитное называют точкой Кюри (рис.2).
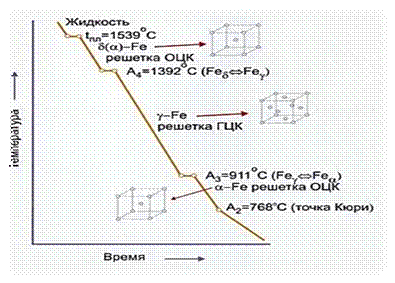
Рис.2. Температурный полиморфизм железа
Высокотемпературная модификация Feγ парамагнитна, что позволяет легко обнаруживать тот и другой вид решетки магнитными методами.
В точке 1392°С совершается новое полиморфное превращение, при котором образуется d-Fe с объемно центрированной кубической решеткой. Это строение железо сохраняет до температуры плавления. Данная модификация парамагнитна.
Высокотемпературное превращение γ-железа в δ-железо с ОЦК решеткой меньше влияет на структуру и свойства сплавов.
Высокотемпературная модификация Feγ парамагнитна, что позволяет легко обнаруживать тот и другой вид решетки магнитными методами.
Высокотемпературное превращение γ-железа в δ-железо с ОЦК решеткой меньше влияет на структуру и свойства сплавов.
Углерод – химический элемент II периода IV группы периодической системы, химический знак - С, атомный номер 6, радиус 0,077 нм или 0,77 Å; масса 12,011; неметалл. Массовая доля углерода в земной коре составляет 0,1 %. Он встречается в природе в свободном состоянии в двух аллотропических модификациях - алмаза и графита. Алмаз – прозрачное кристаллическое вещество со сложной кубической решеткой, что обеспечивает ему очень высокую твердость. Графит имеет темно-серую окраску с металлическим блеском. Он является жирным на ощупь. По своему строению это слоистое кристаллическое вещество с гексагональной решеткой
Углерод не плавится при нагреве, а возгоняется (переходит в газовую фазу) при температуре 3800ºC. Он мягкий, непрочный, хорошо проводит электричество.
Углерод может растворяться в жидком железе и в решетках обеих полиморфных модификаций, а также образует с железом химическое соединение. Поэтому в сплавах могут присутствовать следующие фазы: жидкий раствор (Ж), феррит (Ф), аустенит (А), цементит (Ц), графит (Г).
Твердые растворы внедрения углерода и других примесей в a-железе называют ферритом, а в g-железе – аустенитом.
Феррит получил свое название от латинского наименования железа – «Ferrum». Различают низкотемпературный a-феррит с растворимостью углерода до 0,02 % и высокотемпературный d-феррит с предельной растворимостью углерода 0,1 %. Атом углерода в решетке феррита располагается в центре объема куба. Под микроскопом феррит выявляется в виде однородных полиэдрических зерен. Твердость и механические свойства феррита близки к таковым технически чистого железа (sв = 250 МПа, s0,2 = 120 МПа, d = 50 %, y = 80 %, НВ 80 – 90 кгс/мм2 или 800 – 900 МПа), они зависят от количества элементов, присутствующих в нем (многие химические элементы образуют с ферритом твердые растворы замещения). Микроструктура феррита представлена на рис.3.
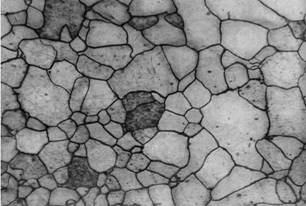
Рис.3. Микроструктура феррита
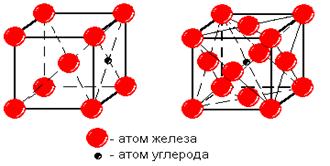 |
Аустенит был назван так в честь английского ученого Роберта Аустена, который занимался исследованиями структуры составляющих системы железо - углерод и разработкой вариантов ее диаграммы состояния. Атом углерода в решетке g - железа располагается в центре элементарной ячейки (рис.4,б).
а б
Рис.4. Кристаллическая решетка феррита (а) и аустенита (б)
Аустенит – парамагнитен, высокопластичен (НВ = 170 – 220 кгс/мм2 или 1700 – 2200 МПа), имеет низкие механические характеристики, такие как пределы текучести и Аустенит – парамагнитен, высокопластичен (НВ = 170 – 220 кгс/мм2 или 1700 – 2200 МПа), имеет низкие механические характеристики, такие как пределы текучести и прочности. Микроструктура аустенита - полиэдрические зерна (рис.5).
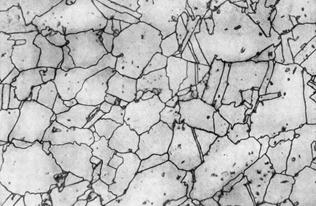
Рис.5. Микроструктура аустенита
Железо и углерод, взаимодействуя друг с другом, могут образовывать ряд металлических карбидов с различными химическими формулами: Fе3С, Fе2С, FеС и другие. Наиболее распространенным и широко применяемым из них является карбид железа среднего состава Fе3С – цементит. Стехиометрическое соотношение элементов в нем соответственно равно 3/1. Содержание углерода составляет 6,67 % масс.
Кристаллическая решетка карбида железа очень сложная. Она представляет собой орторомбическую структуру с плотной упаковкой атомов (в элементарной ячейке расположено 12 атомов железа и 4 углерода). Характер связи между атомами железа чисто металлический, а между железом и углеродом ионно-металлический. Такое строение приводит к тому, что он проявляет металлические признаки: блеск, высокая электропроводность, уменьшающаяся с повышением температуры, легкость образования твердых растворов с металлами.
Данное соединение обладает высокой твердостью, сравнимой только с алмазом, он легко царапает стекло (НВ более 800 кгс/мм2), но чрезвычайно низкой практически нулевой пластичностью (большой хрупкостью), значительной жаропрочностью и обычно более высокой температурой плавления, чем исходный металл.
 2015-03-08
2015-03-08 3041
3041
