Зависимость скорости большинства химических реакций от температуры описывается эмпирическим правилом Вант-Гоффа: при увеличении температуры на каждые 10° скорость реакции возрастает в 2 – 4 раза. Эта величина называется температурным коэффициентом реакции, или коэффициентом Вант-Гоффа и обозначается γ:
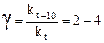 .
.
Закон Вант-Гоффа:
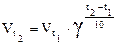 .
.
Рассчитаем для примера, во сколько раз увеличится скорость реакции при повышении температуры на 100°, если g = 2. Подставим исходные данные в уравнение Вант-Гоффа:
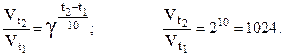
Правило Вант-Гоффа выполняется только для реакций, энергия активации которых лежит в пределах 84 – 170 кДж/моль. Оно было сформулировано на основе экспериментального изучения таких реакций при относительно низких температурах (g = 2 – 4).
Выполнение опыта. Приготовить три термостата, для чего три стаканчика объемом 200 - 250 мл наполнить на 2/3 водой и каждый стаканчик накрыть картонной крышкой с тремя отверстиями:
В одно отверстие каждого термостата поместить термометр, в другое – коническую пробирку с 2 н. раствором серной кислоты и опущенной в нее пипеткой, в третье – пробирку с 10 каплями 1 н. раствора тиосульфата натрия.
Первый стаканчик оставить на столе при комнатной температуре; второй и третий стаканчики поочередно поместить в водяную баню и нагреть второй стаканчик - до температуры на 10°C выше, чем в первый, а третий - на 10°C выше, чем второй.
Не вынимая пробирки с тиосульфатом натрия из термостатов, добавить в них по 1 капле 2 н. серной кислоты из того же термостата.
Отметить время от момента добавления кислоты до появления заметного помутнения раствора в каждом из термостатов. Время протекания реакций определять секундомером или метрономом.
Результаты записать в форме таблицы:
| Номер пробирки | Температура | Время появления мути t, с | V = 1/t |
Результаты опыта представить графически, отложив скорость реакции V = 1/t на оси ординат, а температуру проведения опыта – на оси абсцисс.
Сформулировать вывод о зависимости скорости реакции от температуры для данного опыта. Определить температурный коэффициент скорости для данной реакции.
 2015-04-01
2015-04-01 841
841








