Үйкелiс күшiнiң әсерiнен тербелiп тұрған жүйенiң тербелiсi бiрте-бiрте өше бастайды. Ал ендi тербелмелi жүйеге сырттан қосымша күшпен әсер ететiн болсақ, онда ол жүйе тербеле бастайды. Периодты сыртқы күштiң әсерiнен пайда болатын тербелiстi ерiксiз тербелiс деп атайды. Жүйеге әсер ететiн сыртқы күш (Ғс.к.) мына гармоникалық заңмен өрнектеледi:
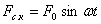 ,
,
мұндағы: Ғ0- сыртқы күштiң амплитудасы, ω- сыртқы күштiң циклдiк жиiлiгi.
Сырттан әсер ететiн күштiң жиiлiгi ω, ал тербелiп тұрған жүйенiң жиiлiгiн ω0 десек, онда Ньютонның 2-шi заңы бойынша
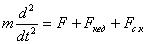 немесе
немесе 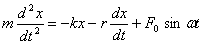 .
.
Осы өрнектiң екi жағын да m-ге бөлiп, 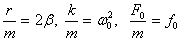 белгiлеулерiн енгiзсек, ерiксiз тербелiстiң дифференциалдық теңдеуiн аламыз:
белгiлеулерiн енгiзсек, ерiксiз тербелiстiң дифференциалдық теңдеуiн аламыз:
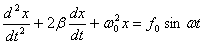 .
.
Теңдеудiң дербес шешiмі:
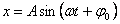 .
.
Бұл тербелiстiң амплитудасы мен фазасы:
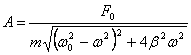 және
және 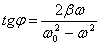 .
.
Егер сырттан әсер ететiн күштiң жиiлiгi (ω) тербелiп тұрған жүйенiң меншікті жиiлiгiне (ω0) тең болса, онда ерiксiз тербелiстiң амплитудасы күрт артады. Оны амплитуданың соңғы формуласынан байқауға болады. Осы кезде байқалатын құбылысты, яғни амплитуданың өте тез артуын резонанс деп атайды.
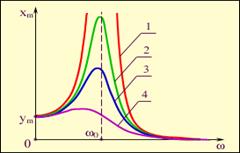
Суретте 4-шi қисық өшу коэффициентi ең үлкен, 1-шi қисық ең кiшi болған жағдайдағы резонанстық графиктер берiлген.
Механикалық толқындар
Бөлшектерi бiр-бiрiмен өте тығыз байланысқан серпiмдi ортаның бiр нүктесi тербелiске түссiн. Оның тербелiсi көршi нүктеге берiледi, оның тербелiсi келесi нүктеге т.с.с. берiледi. Сөйтiп, тербелiс әрi қарай тарала бередi. Тербелiстiң ортада таралу процесiн толқындық процесс немесе толқын деп атайды.
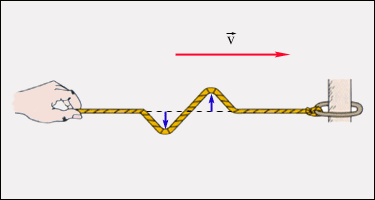
Орта бөлшектерiнiң тербелiсi толқынның таралу бағытына перпендикуляр бағытта болса, ондай толқындарды көлденең толқындар деп атайды. Суреттегi резеңке жiптегi таралатын толқын көлденең толқын болып табылады.
Егер тербелiс тарап отырған орта бөлшектерiнiң тербелiс бағыты толқынның таралу бағытымен бағыттас болса, ондай толқындарды қума толқындар деп атайды. Қума толқынның пайда болуы суретте көрсетiлген. Балғамен серпiмдi стерженнiң бүйiрiнен соққанда стерженде таралатын толқын қума толқын болып таралады.
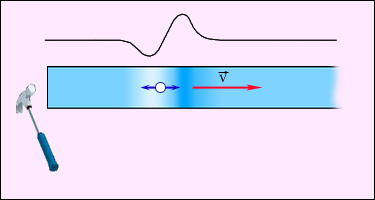
Толқын таралатын ортаның серпiмдiлiк қасиетiне байланысты қума немесе көлденең толқын пайда болады.
Газдарда, сұйықтарда тек қана қума толқындар тарай алады. Газдардағы қума толқын мына формуламен анықталады:
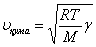 ,
,
мұндағы: 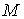 - молярлық масса,
- молярлық масса, 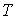 - абсолют температура,
- абсолют температура, 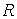 - универсал газ тұрақтысы,
- универсал газ тұрақтысы, 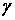 - ¼лшемсiз шама,
- ¼лшемсiз шама, 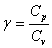 шамасы адиабата көрсеткіші деп аталады, ол ауа үшiн
шамасы адиабата көрсеткіші деп аталады, ол ауа үшiн 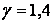 -ге тең.
-ге тең.
Қатты денелерде қума және көлденең толқын тарай алады. Қатты денелердегi қума толқын 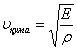 , ал көлденең толқын
, ал көлденең толқын 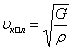 формулаларымен өрнектеледi. Мұндағы:
формулаларымен өрнектеледi. Мұндағы: 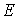 - Юнг модулi,
- Юнг модулi, 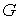 - ығысу модулi,
- ығысу модулi, 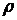 - ортаның тығыздығы.
- ортаның тығыздығы.
Қатты денелерде көлденең толқындардың жылдамдығы қума толқындардың жылдамдығынан аз болады. Мысалы, болатта таралатын қума толқынның жылдамдығы 
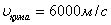 , көлденең толқынның жылдамдығы
, көлденең толқынның жылдамдығы 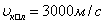 . Осы екi толқынның таралу жылдамдығының айырмашылығын жер сiлкiну аймағын анықтауға пайдаланады. Жер сiлкiнгенде қума толқындар көлденең толқындарға қарағанда тезiрек таралып (аталған толқындардың жылдамдығын велосиграф, ал үдеуiн акселерограф тiркейдi) тiркеуiш құралға бұрын жетедi. Осы екi толқынның тiркеуiш құралға жету уақытының айырмашылықтарын бiле отырып, жер сiлкiнудiң эпицентрiн оңай анықтауға болады. Осы екi әдiспен жер қойнауындағы газ, мұнай қоры зерттеледi.
. Осы екi толқынның таралу жылдамдығының айырмашылығын жер сiлкiну аймағын анықтауға пайдаланады. Жер сiлкiнгенде қума толқындар көлденең толқындарға қарағанда тезiрек таралып (аталған толқындардың жылдамдығын велосиграф, ал үдеуiн акселерограф тiркейдi) тiркеуiш құралға бұрын жетедi. Осы екi толқынның тiркеуiш құралға жету уақытының айырмашылықтарын бiле отырып, жер сiлкiнудiң эпицентрiн оңай анықтауға болады. Осы екi әдiспен жер қойнауындағы газ, мұнай қоры зерттеледi.
Сұйықтарда таралатын қума толқын мына формуламен анықталады: 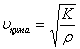 , мұндағы
, мұндағы 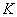 - жан-жақты сығу модулi.
- жан-жақты сығу модулi.
Толқын таралған кезде энергия тасымалданады. Ол тербелiстегi бөлшектердiң кинетикалық энергиясымен деформацияланған серпiмдi ортаның потенциялдық энергиясының қосындысына тең:
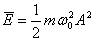 .
.
Толқын таралып отырған ортадан 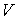 көлемiн алып, онда осы формуламен анықталатын энергия бар деп есептейiк. Сонда энергияны көлемге бөлiп толқыí энергиясының орташа тығыздығын табамыз:
көлемiн алып, онда осы формуламен анықталатын энергия бар деп есептейiк. Сонда энергияны көлемге бөлiп толқыí энергиясының орташа тығыздығын табамыз:
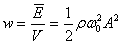 ,
,
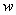 - толқын энергиясының орташа тығыздығы.
- толқын энергиясының орташа тығыздығы.
Бiрлiк уақыт iшiнде бiрлiк ауданнан өтетiн энергия шамасын толқын интенсивтiгi деп атайды: 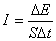 .
.
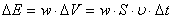 ,
,
онда 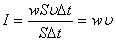 немесе вектор түрiнде жазсақ:
немесе вектор түрiнде жазсақ:
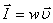 ,
,
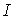 - векторы Умов векторы деп аталады, мұндағы
- векторы Умов векторы деп аталады, мұндағы 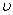 - толқын жылдамдығы. Бұған
- толқын жылдамдығы. Бұған 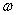 - ның мәнiн қойсақ:
- ның мәнiн қойсақ:
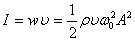 ,
,
мұндағы: 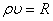 толқындық немесе акустикалық кедергi деп аталады.
толқындық немесе акустикалық кедергi деп аталады.
Дыбыс толқындары
Дыбысты және оның заттармен әсерлесуiн зерттейтiн физиканың бөлiмiн акустика деп атайды. Тербелiс жиiлiгi 16 –20000 Гц аралығында жататын ауадағы серпiмдi механикалық толқындар адам құлағына жеткенде дыбыс сезiмiн тудырады.
Сондықтан, кез-келген ортадағы тербелiс жиiлiгi жоғарыда айтылған аралықта жататын серпiмдi толқындарды дыбыс толқындары немесе қысқаша – дыбыс деп атайды. Жиiлiгi 16 Гц-тен төмен серпiмдi толқындарды - инфрадыбыс, ал тербелiс жиiлiгi 20000 Гц-тен жоғары серпiмдi толқындарды – ультрадыбыс деп атайды. Инфра және ультра дыбыстарды адам естiмейдi.
Дыбыс толқындары тасымалдайтын энергия ағынының уақыт бойынша орта мәнiн дыбыс интенсивтiлiгi деп атайды.
Есту сезiмiн тудыру үшiн дыбыстың есту табалдырығы деп аталатын ең аз белгiлi бiр интенсивтiлiгi болуы қажет. Адам құлағы тербелiс жиiлiгi 1000 Гц-тен 4000 Гц аралығындағы дыбысқа сезiмтал келедi. Осы облыстардағы есту табалдырығы шамамен 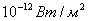 болады. Интенсивтiлiгi
болады. Интенсивтiлiгi 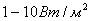 шамасында дыбыс есту органдарында ауру сезiмiн тудырады (ауыру сезiмiнiң табалдырығы). Ауыру сезiмiнiң табалдырығы, сондай-ақ, есту табалдырығы жиiлiкке тәуелдi болады (сурет).
шамасында дыбыс есту органдарында ауру сезiмiн тудырады (ауыру сезiмiнiң табалдырығы). Ауыру сезiмiнiң табалдырығы, сондай-ақ, есту табалдырығы жиiлiкке тәуелдi болады (сурет).
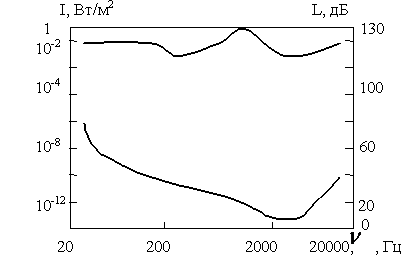
Субьективтi сезiлетiн дыбыс қаттылығы дыбыс толқындарының интенсивтiлiгiне қарағанда баяу өседi. Интенсивтiлiк геометриялық прогрессиямен өскенде дыбыс қаттылығы арифметикалық прогрессиямен өседi.
Дыбыс қаттылығының деңгейi 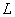 қарастырылатын дыбыстың интенсивтiлiгiнiң
қарастырылатын дыбыстың интенсивтiлiгiнiң 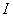 есту сезiмiн тудыратын дыбысқаттылығына
есту сезiмiн тудыратын дыбысқаттылығына 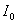 қатынасының логарифмi түрiнде анықталады:
қатынасының логарифмi түрiнде анықталады:
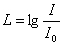 .
.
Бұл заң Вебер-Фехнер заңы деп аталады. Дыбыс қаттылығының өлшем бiрлiгi Бел (Б) деп аталады. Көп жағдайда 10 есе кiшi бiрлiкпен – децибелмен (дБ) өлшейдi. Децибелдегi дыбыс қаттылығы келесi формуламен анықталады:
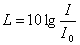 .
.
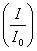 екi интенсивтiлiктердiң қатынасы децибел түрiнде келесi түрде өрнектеледi:
екi интенсивтiлiктердiң қатынасы децибел түрiнде келесi түрде өрнектеледi: 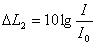 .
.
Осы формуланың көмегiмен белгiлi бiр ара қашықтықтағы толқынның интенсивтiлiгiнiң кемуiн децибелмен өрнектеуге болады. Адамның есту органдарында есту сезiмiн тудыратын интенсивтiлiктiң ( 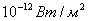 -ден
-ден 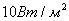 -ке дейiн) барлық диапазоны дыбыс қаттылығының 0-ден 130 дБ-ге дейiнгi мәндерiне сәйкес келедi. Кейбiр дыбыстардың дыбыс қаттылығының мәндерi төмендегi кестеде көрсетiлген.
-ке дейiн) барлық диапазоны дыбыс қаттылығының 0-ден 130 дБ-ге дейiнгi мәндерiне сәйкес келедi. Кейбiр дыбыстардың дыбыс қаттылығының мәндерi төмендегi кестеде көрсетiлген.
Молекулалық физика және термодинамика
Газ заңдары. Изопроцестер
Термодинамикалық процесс деп қарастырылатын термодинамикалық жүйенің параметрлерінің өзгеруімен сипатталатын жүйенің күйінің өзгеруін айтады.
Берілген жағдайда атомдарының арасындағы өзара әсерлесу күші елеусіз аз болатын газды идеал газ деп атайды.
Қалыпты жағдайдағы газдарды идеал газ деп есептеуге болады. Термодинамикалық параметрлер арасындағы байланысты анықтайтын теңдеуді күй теңдеуі деп атайды.
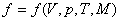 .
.
1. Изотермиялық процесс:
Тұрақты температурада өтетін процесс изотермиялық процесс деп аталады.
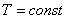 .
.
Изотермиялық процесті сипаттайтын заңды ағылшын ғалымы Бойль мен француз ғалымы Мариот бір-бірінен тәуелсіз, тәжірибе жүзінде алды. Сондықтан бұл заң Бойль-Мариот заңы деп аталады.
Берілген газдың массасы үшін тұрақты температурада газ қысымының көлемге көбейтіндісі тұрақты болады.
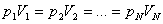 немесе
немесе 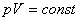
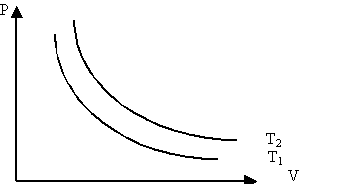
Изотермиялық процесті сипаттайтын графикті изотерма деп атайды. Графикте Т1<Т2.
2. Изобаралық процесс:
Тұрақты қысымда өтетін процесс изобаралық пр оцесс деп аталады.
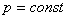 .
.
Изобаралық процесті сипаттайтын заңды француз ғалымы Гей-Люссак тәжірибе жүзінде алды. Сондықтан бұл заң Гей-Люссак заңы деп аталады.
Берілген газдың массасы үшін тұрақты қысымда газ көлемінің температураға қатынасы тұрақты болады.
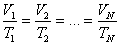 немесе
немесе 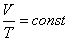 .
.
Гей-Люссак заңын Цельсий шкаласындағы температураны пайдаланып келесі түрде жазылады:
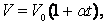
мұндағы: 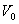 -
- 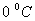 температурадағы газ көлемі,
температурадағы газ көлемі, 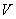 -
- 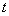 температурадағы газ көлемі,
температурадағы газ көлемі, 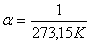 - газ көлемінің ұлғаюының температуралық коэффициенті.
- газ көлемінің ұлғаюының температуралық коэффициенті.
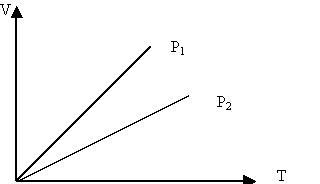
Изобаралық процесті сипаттайтын графикті изобара деп атайды. Графикте р1<р2.
3. Изохоралық процесс:
Тұрақты көлемде өтетін процес изохоралық процесс деп аталады.
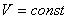 .
.
Изохоралық процесті сипаттайтын заңды француз ғалымы Шарль тәжірибе жүзінде алды. Сондықтан бұл заң Шарльзаңы деп аталады.
Берілген газдың массасы үшін тұрақты көлемде газ қысымының температураға қатынасы тұрақты болады.
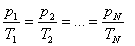 немесе
немесе 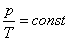 .
.
Шарль заңын Цельсий шкаласындағы температураны пайдаланып келесі түрде жазылады:
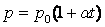 ,
,
мұндағы: 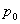 -
- 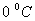 температурадағы газ қысымы,
температурадағы газ қысымы, 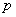 -
- 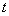 температурадағы газ қысымы,
температурадағы газ қысымы, 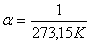 - газ қысымының температуралық коэффициенті.
- газ қысымының температуралық коэффициенті.
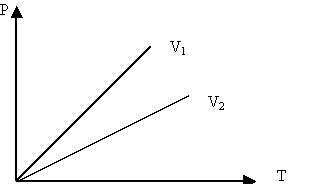
Изохоралық процесті сипаттайтын графикті изохора деп атайды. Графикте V1<V2.
8.1.Авогадро заңы
Температуралары және қысымдары бірдей кез-келген газдардың бір молінің көлемдері де бірдей болады.
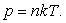
Қалыпты жағдайда ( 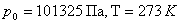 ) кез-келген газдың 1 м3 көлемінде
) кез-келген газдың 1 м3 көлемінде 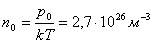 молекула болады. Бұл сан Лошмидт саны деп аталады.
молекула болады. Бұл сан Лошмидт саны деп аталады.
Клапейрон теңдеуі
1834 жылы француз ғалымы Клапейрон Бойль-Мариот және Гей-Люссак заңдарын біріктіре отырып, (р,Т,V) параметрлерінің үшеуі де өзгергенде жүретін процестерді сипаттайтын теңдеуді алды. Бұл теңдеу Клапейрон теңдеуі деп аталады.
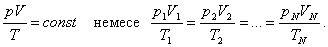
Идеал газ күйінің теңдеуі
Орыс ғалымы Д.И. Менделеев Клайперон және Авогадро заңдарын біріктіре отырып идеал газ күйінің теңдеуін алды:
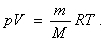
мұндағы: R-универсал газ тұрақтысы, R= 8,31 Дж/(моль·К).
Бұл теңдеу кейде Менделеев-Клапейрон теңдеуі деп аталады.
Дальтон заңы
Қоспа газдардың қысымы Дальтон заңының көмегімен анықталады:
Қоспа газдардың қысымы қоспаны құрайтын жеке газдардың парциаль қысымдарының қосындысына тең болады:
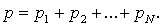
Парциаль қысым деп қоспадағы басқа газдардың қысымын ескермеген жағдайдағы жеке газдардың түсіретін қысымын айтады.
Қоспа газдарға Менделеев-Клапейрон теңдеуін қолдануға болады.

мұндағы: 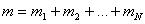 - қоспа газдың толық массасы,
- қоспа газдың толық массасы, 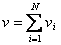 - қоспа газдың зат мөлшері,
- қоспа газдың зат мөлшері, 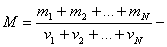 қоспа газдың мольдік массасы,
қоспа газдың мольдік массасы, 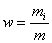 - қоспа газдағы жеке газдардың үлесі.
- қоспа газдағы жеке газдардың үлесі.
Газдардың молекула-кинетикалық теориясы
Газдардың физикалық қасиеттерін зерттеуге статистикалық әдісті қолданайық.
Молекула –кинетикалық теорияның негізгі қағидалары:
1. Барлық заттар бөлшектерден тұрады (молекулалар мен атомдардан);
2. Осы бөлшектер тәртіпсіз, хаостық қозғалыста болады. Бұл қозғалыс жылулық қозғалыс деп аталады;
3. Бөлшектер бір-бірімен өзара әсерлеседі.
Зат бөлшектерінің жылулық қозғалысын қөрнекі түрде көрсететін тәжірибені ағылшын ғалымы Броун жасады. Броун микроскоптың көмегімен сұйықта қалқыған гүл тозаңдарының жылдам, тәртіпсіз қозғалысын бақылады. Осындай зат бөлшектерінің жылулық қозғалысын Броундық қозғалыс деп атайды.

Молекула –кинетикалық теорияның негізгі теңдеуі
Макроскопиялық параметрлердің (қысым, көлем) микроскопиялық параметрлермен (молекулалардың массасы, жылулық қозғалыс жылдамдығы, кинетикалық энергиясы) арасындағы байланысты көрсететін өрнекті молекула-кинетикалық теорияның негізгі теңдеуі деп атайды.
Молекулалардың орташа жылдамдығы:
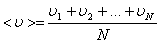
өрнегімен анықталады.
Молекулалар концентрациясы - 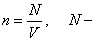 молекулалар саны. Концентрация деп бірлік көлемдегі бөлшектер санын айтамыз. Өлшем бірлігі
молекулалар саны. Концентрация деп бірлік көлемдегі бөлшектер санын айтамыз. Өлшем бірлігі 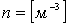 .
.
Бір бағытта қозғалатын бөлшектер саны- 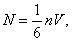
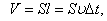
Сонымен 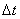 -уақытта ауданы S-қабырғаға соқтығысатын молекулалар саны-
-уақытта ауданы S-қабырғаға соқтығысатын молекулалар саны-
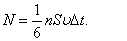
Әрбір молекула қабырғаға F1-күшпен әсер етеді: 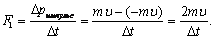
Соқтығысатын барлық молекулалардың қабырғаға әсер ететін қысым күші: 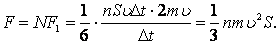
Әр түрлі молекулалардың түрліше 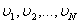 жылдамдықтармен қозғалатынын ескерсек, өрнекке молекулалардың жылдамдығының квадратының орташа мәні койылады.
жылдамдықтармен қозғалатынын ескерсек, өрнекке молекулалардың жылдамдығының квадратының орташа мәні койылады.
Молекулалардың орташа квадраттық жылдамдығы:
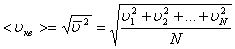 .
.
Қысым күштің күш әсер ететін ауданына қатынасымен анықталады:
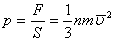 немесе
немесе 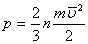 ,
,
осыдан 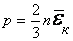 екенін анықтаймыз,
екенін анықтаймыз,
мұндағы: 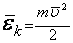 - газ молекуласының ілгерілемелі қозғалысының кинетикалық энергиясының орташа мәні.
- газ молекуласының ілгерілемелі қозғалысының кинетикалық энергиясының орташа мәні.
Осы алынған өрнекті молекула-кинетикалық теорияның негізгі теңдеуі немесе Клаузиус теңдеуі деп атайды.
Газдың қысымы газ молекулаларының жылулық қозғалысының орташа кинетикалық энергиясына тура пропорционал болады.
Температураның негізгі физикалық мағынасын көрсететін өрнек- 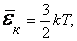
мұндағы- 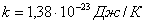 Больцман тұрақтысы деп аталады.
Больцман тұрақтысы деп аталады.
Температура газ молекуласының орташа кинетикалық энергиясының сандық мөлшері болып табылады. Больцман тұрақтысы температура 1 Кельвинге өзгергенде газ молекуласының орташа кинетикалық энергиясы қаншаға өзгеретінін көрсетеді.
Газ молекуласының еркіндік дәрежесі
Газ молекуласының еркіндік дәрежесі деп молекуланың кеңістіктегі орнын анықтайтын тәуелсіз параметрлердің жиынтығын айтамыз. Егер кез-келген дене кеңістікте қозғалатын болса, онда осы қозғалысты тәуелсіз алты қозғалыстың жиынтығы түрінде қарастыруға болады: үш ілгерілемелі қозғалыстың (тікбұрышты координаталар жүйесінің осьтері бойымен), үш айналмалы қозғалыстың (дененің массалар центрі арқылы өтетін өзара перпендикуляр үш осьтің айналасында) жиынтығы.
Қалыпты жағдайда газ молекулаларының еркіндік дәрежесі:
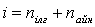
Жоғары температураларда бұл еркіндік дәрежесіне тербелмелі қозғалыстың бұл еркіндік дәрежесі қосылады.
Бір атомды газ үш бағытта ілгерілемелі қозғала алады. Сондықтан бір атомды газдың еркіндік дәрежесі 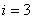 -ке тең.
-ке тең.
Екі атомды газ үш бағытта ілгерілемелі және екі бағытта айналмалы қозғала алады (сурет). Сондықтан екі атомды газдың еркіндік дәрежесі 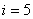 -ке тең болады.
-ке тең болады.
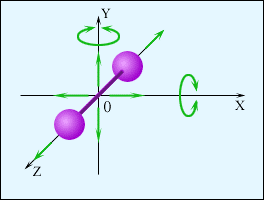
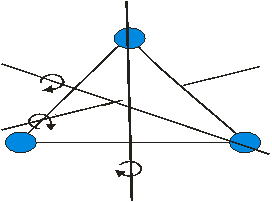
2-атомды газ үшін 3-атомды газ үшін
Үш атомды газ үш бағытта ілгерлемелі және үш бағытта айналмалы қозғала алады Сондықтан үш атомды газдың еркіндік дәрежесі 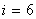 -ға тең болады.
-ға тең болады.
 2015-04-12
2015-04-12 1553
1553








