Для хим.реакций равновесным считается состояние, в котором приходит система при постоянных внешних условиях, характеризуемый неизменностью во времени термодинамических параметров и отсутствием в системе потока вещества и теплоты.
аА+вВ→сС+dD
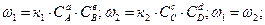
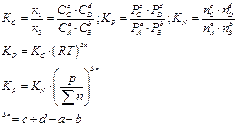
Константа равновесия не зависит от V и P, а зависит от Т.
Наличие отрицательной энергии Гиббса не свидетельствует о том, что процесс будет протекать в каком-либо обозримом будущем. Но это является необходимым условием для протекания самопроизвольно данного процесса в прямом направлении.
∆G=∆H−T∆S
∆G – энергия Гиббса, Дж/моль
∆H – энтальпия, Дж/моль
∆S – энтропия, Дж/(моль*К)
1.Если ∆H<0,∆S>0, то система самопроизвольно протекает в прямом направлении при любом значении температуры.
2.Если ∆H>0,∆S<0, то система самопроизвольно протекает в прямом направлении при любой тем-ре.
3.Если ∆H<0,∆S<0, то система самопроизвольно протек. в прямом направлении при Т<Тпредельного.
4.Если ∆H>0,∆S>0,то система самопроизвольно протек. в прямом направлении при Т>Тпредельного Тпред.= ∆H/∆S
 2015-04-17
2015-04-17 1417
1417








