Главное квантовое число (n) – квантовое число, определяющее энергетические уровни электрона в атоме: n=1,2,3,...∞. 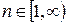
Однако экспериментальные данные о спектрах сложных атомов не объяснялись с точки зрения теории Бора.
Объяснение этих данных потребовало введение еще одного квантового числа, которое получило название орбитального квантового числа.
Орбитальное квантовое число (l) –квантовое число, определяющее момент импульса электрона в атоме, изменяется в пределах: l=0,1,2,…,n-1. 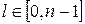
Момент импульса электрона (механический орбитальный момент равен l=mvrn) в квантовой механике имеет вид:
В атоме водорода полная энергия не зависит от значения l, а зависит только от п. Но в атомах с двумя и большим числом электронов энергия зависит от обоих квантовых чисел п и l.
Однако и этих двух квантовых чисел оказалось недостаточно. Оказалось, что в некоторых условиях эти уровни начинают расщепляться. Например, расщепление спектральных линий, соответствующих энергетическим уровням, на несколько, близко лежащих по энергии друг от друга линий, происходит при помещении атома в магнитное поле (в этом случае наблюдаемое расщепление получило название эффекта Зеемана). Набор расщепленных линий получил название тонкой структуры атома. Для объяснения этого эффекта понадобилось введение еще одного квантового числа, которое возникло по результатам анализа экспериментов в магнитном поле и получило название «магнитного квантового числа».
Магнитное квантовое число (m) – квантовое число, определяющее проекцию момента импульса электрона на заданное направление: m=0,±1,±2,...,±l, всего (2l+1) значений 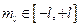 .
.
Именно наличие магнитного квантового числа приводит к расщеплению энергетического уровня на 2l+1 подуровней. Расщепление атомных уровней в магнитном поле на несколько близких по энергии линий получило название тонкой структуры.
Наличие трех квантовых чисел не смогло дать объяснение всех экспериментальных данных. Тщательное исследование спектральных линий атома водорода показало, что каждая линия в действительности состоит из двух линий, находящихся очень близко друг от друга. Такое расщепление уровней получило название сверх тонкой структуры атомных уровней. Для их объяснения появилось четвертое квантовое число, называемое спином. С точки классической механики это как бы вращение электрона вокруг своей оси, как, например, Земля, вращаясь вокруг Солнца, еще вращается и вокруг своей оси. Момент количества движения электрона или внутренний момент в этом случае может иметь два направления «вверх» и «вниз».
Спин электрона (s) – собственный неуничтожаемый механический момент импульса, не связанный с движением электрона в пространстве. Спин элементарных частиц, а также других микрочастиц, (в том числе ядер и атомов) – это квантовая величина, у которой нет классического аналога; это – внутреннее неотъемлемое свойство электрона. У электрона спин равен ½. Вводится понятие проекции спина на некоторую ось, проходящую через частицу. Проекции спина 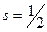 составляют
составляют 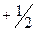 ,
, 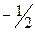 , то есть проекции спина принимают значения от +s до –s:
, то есть проекции спина принимают значения от +s до –s: 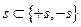
Как оказалось, этих четырех квантовых чисел (n, l, ml, s) достаточно, чтобы описать спектры всех сложных атомов с любой заданной точность
 2015-04-17
2015-04-17 3788
3788
