Лекция 2. Органические вещества. Белки
Органические вещества.
О рганические соединения составляют в среднем 20–30% массы клетки живого организма. К ним относятся биологические полимеры – белки, нуклеиновые кислоты и полисахариды, а также жиры и ряд низкомолекулярных органических веществ – аминокислоты, простые сахара, нуклеотиды и т.д. Полимеры – сложные разветвленные или линейные молекулы, при гидролизе распадающиеся до мономеров. Если полимер состоит из одного вида мономеров, то такой полимер называют гомополимером, если в состав полимерной молекулы входят различные мономеры – то это гетерополимер. Если группа различных мономеров в полимерной молекуле повторяется (А,Б,В,А,Б,В,А,Б,В) – это регулярный гетерополимер, если нет повторения определенной группы мономеров – гетерополимер нерегулярный.
|
Белки.
Из органических веществ клетки по количеству и значению на первом месте стоят белки. Белки, или протеины (от греч. протос – первый, главный) – высокомолекулярные гетерополимеры, органические вещества и распадающиеся при гидролизе до аминокислот. Значение белков настолько велико, что информация о белках включена в два наиболее популярных определения Жизни: «Жизнь есть способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей их внешней природой, причем с прекращением этого обмена веществ прекращается и жизнь, что приводит к разложению белка» (Ф.Энгельс). «Живые тела, существующие на Земле, представляют собой открытые, саморегулирующиеся и самовоспроизводящиеся системы, построенными из биополимеров – белков и нуклеиновых кислот» (М.В.Волькенштейн).
В состав простых белков (состоящих только из аминокислот) входят углерод, водород, азот, кислород и сера. Часть белков (сложные белки) образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь – это сложные белки, содержащие помимо аминокислот еще и небелковую — простетическую группу. Она может быть представлена ионами металлов (металлопротеины — гемоглобин), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины).
Белки обладают огромной молекулярной массой: Один из белков – глобулин молока – имеет молекулярную массу 42000. Его формула С1864Н3012О576N468S21. Существуют белки, молекулярная масса которых в 10 и даже в 100 раз больше. Для сравнения: молекулярная масса спирта – 46, уксусной кислоты – 60, бензола – 78.
Белки представляют собой нерегулярные гетерополимеры, мономерами которых являются α-аминокислоты. В клетках и тканях обнаружено свыше 170 различных аминокислот, но в состав белков входит лишь 20 α-аминокислот. В зависимости от того, могут ли аминокислоты синтезироваться в организме, различают: заменимые аминокислоты – десять аминокислот, синтезируемых в организме и незаменимые аминокислоты – аминокислоты, которые в организме не синтезируются. Незаменимые аминокислоты должны поступать в организм вместе с пищей.
В зависимости от аминокислотного состава, белки бывают полноценными, если содержат весь набор незаменимых аминокислот и неполноценными, если какие-то незаменимые аминокислоты в их составе отсутствуют.
Общая формула аминокислот приведена на рисунке. Все α -аминокислоты при α -атоме углерода содержат атом водорода, карбоксильную группу (-СООН) и аминогруппу (-NH2). Остальная часть молекулы представлена радикалом.
|
|
Пептиды – органические вещества, состоящие из небольшого количества остатков аминокислот, соединенных пептидной связью. Образование пептидов происходит в результате реакции конденсации аминокислот (рис.).
При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой, между ними возникает ковалентная азот-углеродная связь, которую называют пептидной. В зависимости от количества аминокислотных остатков, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т.д. Образование пептидной связи может повторяться многократно. Это приводит к образованию полипептидов. Если полипептид состоит из большого количества остатков аминокислот, то его уже называют белком. На одном конце молекулы находится свободная аминогруппа (его называют N-концом), а на другом – свободная карбоксильная группа (его называют С-концом).
Структура белковой молекулы.
Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков.
Первичная структура белка – последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами – пептидная.
|
В организме человека обнаружено порядка десяти тысяч различных белков, которые отличаются как друг от друга, так и от белков других организмов.
Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в b-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию – транспорт кислорода (в таких случаях у человека развивается заболевание – серповидноклеточная анемия).
Первым белком, у которого была выявлена аминокислотная последовательность, стал гормон инсулин. Исследования проводились в Кембриджском университете Ф.Сэнгером с 1944 по 1954 год. Было выявлено, что молекула инсулина состоит из двух полипептидных цепей (21 и 30 аминокислотных остатков), удерживаемых около друг друга дисульфидными мостиками. За свой кропотливый труд Ф.Сэнгер был удостоен Нобелевской премии.
|
Cкладчатый слой (синоним β-структра) формируется в том случае, если сегменты полипептидных цепей располагаются параллельно или антипараллельно друг другу в один слой. При этом образуется фигура, напоминающая лист, сложенный гармошкой.
|
У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны. По форме молекулы различают белки глобулярные и фибриллярные. Если фибриллярные белки выполняют в основном опорные функции, то глобулярные белки растворимы и выполняют множество функций в цитоплазме клеток или во внутренней среде организма.
|
Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя a-субъединицами (141 аминокислотный остаток) и двумя b-субъединицами (146 аминокислотных остатков).С каждой субъединицей связана молекула гема, содержащая железо.
|
Если по каким-либо причинам пространственная конформация белков отклоняется от нормальной, белок не может выполнять свои функции
 2015-04-17
2015-04-17 628
628


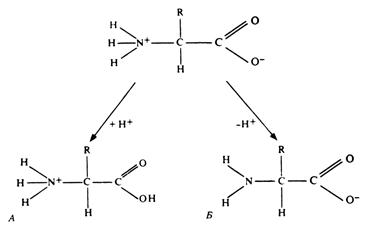 Рис. 255. Амфотерные свойства аминокислот при различных рН.
Рис. 255. Амфотерные свойства аминокислот при различных рН.
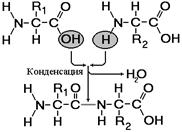 Рис. 256. Образование дипептида.
Рис. 256. Образование дипептида.
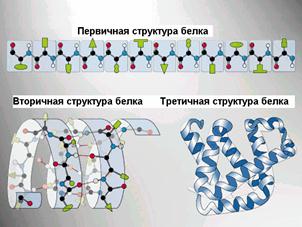
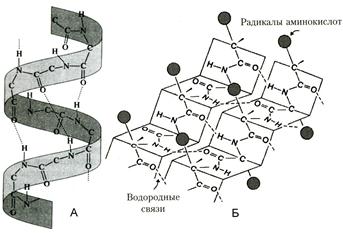 Рис.. Вторичные структуры белка
Рис.. Вторичные структуры белка
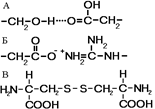 Рис.. Связи, стабилизирующие третичную структуру:
А — водородные, Б — ионные, В — дисульфидные.
Рис.. Связи, стабилизирующие третичную структуру:
А — водородные, Б — ионные, В — дисульфидные.
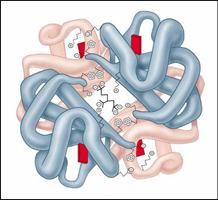 Рис.. Молекула гемоглобина
Рис.. Молекула гемоглобина
 Рис.. Микротрубочка из тубулина
Рис.. Микротрубочка из тубулина







