Гетерогенные процессы в системе «газ - твердое вещество» - широко распространенный вид промышленных химико-технологических процессов. Это процессы обжига различных руд, получения цементного клинкера и др. Однако, даже внутри этой группы, можно выделить определенные разновидности гетерогенных процессов. Наиболее общим случаем является гетерогенная реакция, в которой и среди реагентов, и среди продуктов есть и газообразные, и твердые вещества:
| aA | + | bB | → | rR | + | sS |
| газ | Твердое вещество | газ | Твердое вещество |
К такому типу реакций относится, например, процесс обжига железного (серного) колчедана:
Возможны также реакции, в которых отсутствует или газообразный реагент, или твердый продукт и т.п. Например:
| aA | + | bB | → | rR |
| газ | Твердое вещество | газ |
Кинетические модели гетерогенных процессов
в системе «газ – твердое вещество».
Существует ряд кинетических моделей, несколько упрощающих природу гетерогенных процессов, но позволяющих описать их с помощью сравнительно простых уравнений. Наиболее распространенными среди них являются модель с фронтальным перемещением зоны реакции (модель с непрореагировавшим ядром) и квазигомогенная модель. Рассмотрим, в чем отличие этих моделей на примере гетерогенной реакции
| aA | + | bB | → | rR | + | sS |
| газ | Твердое вещество | газ | Твердое вещество |
при протекании которой внешние размеры твердой частицы не меняются.
Квазигомогенная модель предполагает, что гетерогенный процесс протекает одновременно в любой точке объема твердой частицы. Это возможно, если газообразный реагент может достаточно свободно проникнуть внутрь твердой фазы, т. е. если частица твердого вещества пронизана большим числом пор, а химическая реакция, протекающая на поверхности этих пор, достаточно медленная.
На рис. 14.1 показано, как изменяется концентрация твердого реагента В по объему твердой фазы в разные моменты времени от начала реакции, если гетерогенный процесс протекает в соответствии с квазигомогенной моделью.
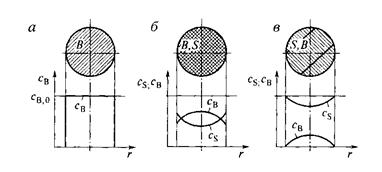
Рис. 14.1. Схематическое изображение твердой частицы в ходе гетерогенного процесса, описываемого квазигомогеиной моделью:
а – до реакции; б – в промежуточный момент реакции; в – почти полностью превращенная частица
Более распространенной является модель с фронтальным перемещением зоны реакции. Согласно этой модели химическая реакция сначала протекает на внешней поверхности частицы, и до тех пор, пока внешний слой твердого реагента полностью не превратится в соответствующие твердые или газообразные продукты реакции, более глубинные слои в реакцию не вступают. Постепенно зона химической реакции продвигается внутрь, оставляя за собой твердый продукт реакции и инертную часть исходного твердого реагента (золу). В произвольный момент времени, твердая частица представляет собой внутреннее ядро, окруженное внешней оболочкой. Ядро состоит из непрореагиропавшего реагента (поэтому эту модель называют иногда моделью с непрореагировавшим ядром). Окружаюшая его оболочка состоит из твердого продукта и инертных веществ. Развитие гетерогенного процесса по этой модели показано на рис. 14.2.
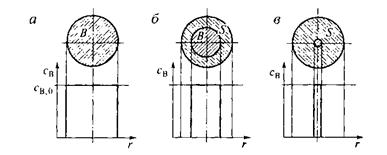
Рис. 14.2. Профиль изменения концентрации твердого реагента В по мере протекания гетерогенного процесса, описываемого моделью с фронтальным перемещением зоны реакции:
а - до реакции; б – промежуточный момент реакции; в – почти полностью превращенная частица
Рассмотрим более детально особенности гетерогенного процесса, описываемого моделью с фронтальным перемещением зоны реакции. Объектом рассмотрения будет одиночная твердая частица с неизменяющимися во времени внешними размерами, обтекаемая потоком газообразного реагента А. Об отдельных этапах процесса будем судить по концентрации реагента А в разных точках пространства (рис. 14.3).
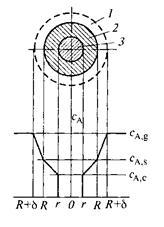
Рис. 14.3. Профиль изменения концентрации газообразного реагента при взаимодействии с твердой частицей (модель с фронтальным перемещением зоны реакции):
1 – пограничная газовая пленка с концентрацией реагента А ниже, чем в газовом потоке; 2 – слой твердых продуктов реакции (слой золы); 3 – ядро непрореагировавшего реагента В
Гетерогенный процесс, описываемый моделью с фронтальным перемещением зоны реакции, можно разделить на пять основных стадий:
1. Внешняя диффузия – подвод реагента А к поверхности твердой частицы через слой газа, обедненный этим компонентом;
2. Внутренняя диффузия – проникновение газообразного реагента через поры твердого продукта реакции к ядру твердого реагента;
3. Химическая реакция на поверхности непрореагировавшего ядра;
4. Внутренняя диффузия газообразных продуктов через слой твердых продуктов;
5. Внешняя диффузия газообразных продуктов в ядро газового потока.
Стадии 4 и 5 в ряде случаев из рассмотрения можно исключить, в частности, тогда, когда протекающая химическая реакция является необратимой.
Основные стадии процесса, описываемого моделью с фронтальным перемещением зоны реакции.
Рассмотрим стадии внешней и внутренней диффузии и поверхностной химической реакции.
Внешняя диффузия.
В результате протекания химической реакции концентрация газообразного
| aA | + | bB | → | продукты |
| газ | Твердое вещество |
реагента А у поверхности твердой частицы ниже, чем в ядре газового потока. Невозможно точно установить пространственное расположение границы, на которой начинается снижение концентрации газообразного реагента, так как при постоянном обтекании частицы газообразным потоком могуг происходить колебания этой границы. Однако условно можно принять, что граница проходит на некотором расстоянии δ от поверхности твердой частицы. Тогда.можно условно зафиксировать поверхностную газовую пленку толщиной δ, характеризующуюся тем, что за ее пределами концентрация газообразного реагента постоянна и равна СA,g (индекс «g» - gas), а внутри пленки СA уменьшается от до концентрации на поверхности твердой частицы СA,s (индекс “S” - от англ. surface – поверхность).
Вещество А переносится из ядра газового потока к поверхности частицы через пограничную газовую пленку, как вследствие молекулярной диффузии, механизм которой рассмотрен выше, так и вследствие движения с газовой средой в направлении, совпадающем с направлением потока, т. е. вследствие конвективного переноса. Суммарный перенос вещества вследствие молекулярной диффузии и конвективного переноса называется конвективной диффузией.
Процесс конвективной диффузии может быть описан дифференциальным уравнением
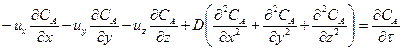
или, в сокращенной записи
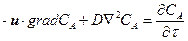
где ux, uy, uz – линейные скорости потока в направлении осей соответственно X, Y, Z.
Так как в этом уравнении переменными величинами являются и концентрация газообразного реагента, и линейная скорость потока, то решать его нужно совместно с дифференциальными уравнениями гидродинамики. В результате получается система дифференциальных уравнений, не имеющая аналитического решения.
Обычно для определения скорости конвективной диффузии пользуются уравнением
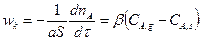 (14.5)
(14.5)
где wk – скорость конвективной диффузии, т. е. количество газообразного реагента А, перенесенное вследствие конвективной диффузии через единицу поверхности в единицу времени; β – коэффициент массоотдачи, зависящий от гидродинамики потока.
Принимают, что у поверхности твердой частицы существует неподвижный диффузионный подслой толщиной δ1, внутри которого перенос вещества осуществляется исключительно вследствие молекулярной диффузии. Скорость внешней диффузии (конвективной) через реальную газовую пленку толщиной δ можно приравнять скорости молекулярной диффузии через диффузионный подслой толщиной δ1 и в соответствии с уравнением (14.4) получим
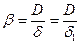
где D – коэффициент молекулярной диффузии.
Повысить скорость внешней диффузии можно, либо увеличивая движущую силу, которая равна разности концентраций СA,g и СA,s, либо коэффициент массоотдачи.
Для увеличения β нужно, либо, если это возможно, повысить коэффициент молекулярной диффузии D; либо уменьшить толщину газовой пленки δ1.
Как было показано выше, коэффициент молекулярной диффузии определяется в основном молекулярной природой веществ, участвующих в процессе диффузии, а также слабо зависит от температуры и давления.
Так, например, коэффициент молекулярной диффузии реагентов в газовую пленку при росте температуры от 700 до 800 К увеличивается лишь в (800/700)1,5 = 1,22 раза. Таким образом, рост температуры проведения процесса не может служить надежным способом интенсификации диффузии.
Значительно больший эффект может быть достигнут при уменьшении толщины пленки δ1. Хотя в рамках принятой модели нельзя точно сказать, чему численно равна δ1, можно с уверенностью утверждать, что все способы уменьшения толщины пленки приведут к увеличению коэффициента массоотдачи. Такими способами являются: увеличение линейной скорости газового потока, обтекающего твердую частицу, приводящее к срыванию пленки; проведение процесса при интенсивном перемешивании частиц твердой фазы, например применение аппаратов с псевдоожиженным слоем твердой фазы.
Внутренняя диффузия.
Если в результате гетерогенного взаимодействия газообразного и твердого реагентов наряду с газообразными образуются и твердые продукты реакции, стадией, предшествующей собственно химической реакции и следующей за внешней диффузией, будет стадия внутренней диффузии – проникновения газообразного реагента через слой твердых продуктов реакции к поверхности ядра, на которой осуществляется химическое взаимодействие.
Скорость внутренней диффузии
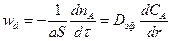
где Dэф – эффективный коэффициент диффузии, учитывающий пористость твердого вещества, извилистость пор и т. д.
Так как слой твердых продуктов реакции создает определенное сопротивление переносу реагента А из пограничной газовой пленки к поверхности ядра, то концентрация этого реагента по мере движения к поверхности ядра будет уменьшаться от СA,s на внешней поверхности твердой частицы до СA,с (индекс «с» от англ. Core – ядро) на поверхности ядра (рис. 14.3).
Если толщина слоя золы невелика, можно принять, что
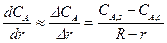
где R – внешний радиус твердой частицы – постоянная величина в рамках рассматриваемого случая частицы с неизменяющимися внешними размерами; r – радиус ядра, уменьшающийся по мере протекания процесса.
Тогда скорость внутренней диффузии можно представить в виде уравнения
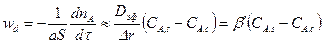 (14.6)
(14.6)
Таким образом, мы получили уравнение скорости внутренней диффузии по своей структуре аналогичное уравнению скорости внешней диффузии: произведение разности концентраций на коэффициент массоотдачи β′ = D / Δr. Повысить скорость стадии внутренней диффузии возможно в основном за счет увеличения коэффициента массоотдачи β′. Существенно повысить коэффициент диффузии, как это было показано, достаточно сложно. Следовательно, нужно идти по пути уменьшения толщины слоя твердых продуктов реакции, равной (R – r). Максимальная толщина этого слоя равна R (при r = 0) – внешнему радиусу твердой частицы. Уменьшение размеров твердой частицы (измельчение) автоматически приводит и к уменьшению толщины слоя твердых продуктов, т. е. к увеличению коэффициента массоотдачи β′. Таким образом, измельчение твердых частиц – основной путь интенсификации внутренней диффузии.
Поверхностная химическая реакция.
Главной стадией гетерогенного химического процесса является поверхностная реакция, в результате которой и происходят все те изменения, которые составляют природу гетерогенного процесса.
Если химическая реакция необратима (а это распространенный класс химических реакций, например реакции горения твердых тел), концентрация газообразного реагента на поверхности ядра уменьшится от концентрации СA,с, достигнутой после стадии внутренней диффузии, до нуля, т. е. до его полного расходования.
Скорость поверхностной реакции может быть описана законами химической кинетики
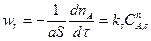 (14.7)
(14.7)
где ks – константа скорости поверхностной химической реакции; n – порядок реакции.
При проведении количественных расчетов следует иметь в виду, что так как скорость поверхностной реакции измеряется количеством вещества, расходуемого в единицу времени на единице реакционной поверхности, например кмоль/(м2∙ч), то это отразится на единицах измерения константы скорости ks
[ ks ] = [ wr ]/[ CA,c ]
Например, для реакции первого порядка
[ ks ] = [ кмоль/(м2ч) ]/[ кмоль/м3 ] = м/ч
в отличие от константы скорости реакции, протекающей в объеме имеющей размерность [ k ] = [ ч-1 ].
Скорость химической стадии может быть, как и в случае предыдущих стадий, увеличена либо вследствие возрастания концентрации газообразного реагента СA,с (для этого нужно, очевидно, увеличивать концентрацию СA,g в потоке, обтекающем частицу), либо же главным образом вследствие роста константы скорости химической реакции ks. Так как в соответствии с уравнением Аррениуса константа скорости химической реакции с ростом температуры увеличивается по экспоненциальному закону, то основной путь интенсификации гетерогенного процесса, протекающего в кинетической области, – повышение температуры.
Константа скорости гетерогенного процесса. Лимитирующая стадия.
Уравнения (14.5), (14.6) и (14.7) позволяют рассчитать скорости отдельных стадий гетерогенного процесса. Однако эти стадии протекают не изолированно, а во взаимодействии друг с другом. Поэтому для расчета скорости гетерогенного процесса нужно иметь уравнение, которое учитывает особенности всех стадий.
Было бы удобно выразить скорость гетерогенного процесса по аналогии с законом действующих масс, как произведение некоторой константы скорости К на концентрацию газообразного реагента в газовом потоке СA,g:
Это оказывается вполне выполнимым для стационарных условий проведения гетерогенного процесса, включающего в себя реакцию первого порядка. При этом используется условие (14.1) о равенстве скоростей последовательных стадий в стационарном режиме.
Выпишем уравнения скоростей отдельных стадий:
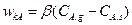 (14.8)
(14.8)
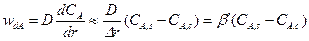 (14.9)
(14.9)
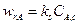 (14.10)
(14.10)
Представим уравнения (14.8) ÷ (14.10) таким образом, чтобы в их правых частях остались только концентрации реагентов, а затем почленно сложим их с учетом того, что в стационарных условиях
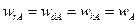
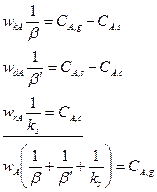
Получаем
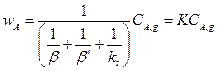 (14.11)
(14.11)
Таким образом, скорость гетерогенного процесса представлена в виде произведения константы скорости гетерогенного процесса К на концентрацию реагента А в газовой фазе СA,g.
Проанализируем структуру константы скорости гетерогенного процесса К. В знаменателе дроби стоит сумма величин, обратных коэффициентам интенсивности отдельных стадий. По аналогии с коэффициентом теплопередачи в теории теплопереноса эту сумму можно рассматривать как сумму сопротивлений на отдельных стадиях гетерогенного процесса.
Возможны ситуации, когда сопротивление одной из стадий существенно превышает сопротивление двух других стадий, т. е. одна стадия затруднена по сравнению с другими. Тогда константа скорости гетерогенного процесса с достаточно хорошим приближением будет равна коэффициенту интенсивности данной стадии.
Например, если 1/ β >> 1/ β′ и 1/ β >>1/ ks, то К ≈ β, а
wA = KCA,g ≈ βCA,g (14.12)
т. е. скорость процесса определяется скоростью конвективной диффузии газообразного реагента A через пограничную газовую пленку. Уравнение (14.12) может быть получено из уравнения скорости конвективной диффузии (14.8) при CA,s = 0. Действительно, если сопротивление со стороны внешней диффузии существенно превышает сопротивление со стороны внутренней диффузии, а поверхностная химическая реакция протекает с высокой скоростью, то практически наблюдаемая концентрация CA,s реагента А на поверхности твердой частицы будет равна нулю, так как все молекулы реагента А, преодолев значительное внешнедиффузионное сопротивление и далее уже не встречая сопротивления, пройдут через слой твердых продуктов и практически мгновенно вступят в реакцию. Таким образом, на этой стадии происходит максимальное изменение концентрации газообразного реагента.
Если такая затрудненная стадия существует, ее называют ЛИМИТИРУЮЩЕЙ. Лимитирующая стадия определяет скорость гетерогенного процесса в целом, поэтому ее называют также скорость-определяющей стадией.
Расчетные зависимости времени протекания гетерогенной реакции от степени превращения твердого реагента.
Рассмотрим взаимодейсгвие одиночной твердой частицы реагента В с обтекающим ее потоком газообразного реагента А по реакции
| aA | + | bB | → | rR | + | sS |
| газ | Твердое вещество | газ | Твердое вещество |
Примем, что твердая частица имеет сферическую форму и во время протекания гетерогенного процесса внешние размеры частицы не меняются. Пусть радиус частицы равен R, радиус ядра - r.
Для установлении зависимости между XB и τ необходимо знать, какова скорость процесса и какими факторами она определяется. Если гетерогенный процесс лимитируется одной из последовательных стадий, то скорость всего процесса равна скорости этой стадии. Тогда вывод зависимости ХВ (τ) существенно упрощается.
Рассмотрим случаи когда процесс лимитируется:
а) внешней диффузией,
б) внутренней диффузией
в) химической реакцией.
Процесс лимитируется внешней диффузией.
Основное сопротивление сосредоточено на стадии проникновения газообразного реагента А через пограничную газовую пленку, обедненную этим реагентом. Скорость гетерогенного процесса, равная в этом случае скорости конвективной диффузии, определяется уравнением
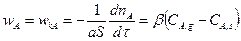 (14.13)
(14.13)
На рис. 14.4, а приведен профиль изменения концентрации газообразного реагента, отвечающий протеканию процесса во внешнедиффузионной области.
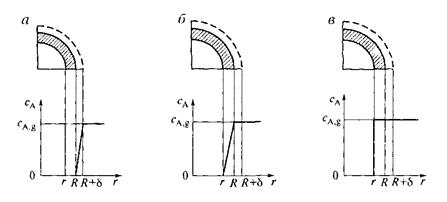
Рис. 14.4. Профиль изменения концентрации газообразного реагента при лимитировании гетерогенного процесса внешней (а), внутренней (б) диффузиями и химической реакцией (в).
Поверхность S, к которой отнесена скорость внешней диффузии, - это внешняя поверхность твердой частицы радиусом R.
S = 4πR2
Решение этого уравнения запишется в виде
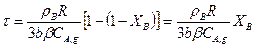 (14.14)
(14.14)
При XB = 1 (весь реагент В прореагировал) уравнение (14.14) позволит определить время полного превращения твердой частицы τп, если гетерогенный процесс лимитируется внешней диффузией:
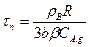 (14.15)
(14.15)
Следовательно, для внешнедиффузионной области протекания гетерогенного процесса, зависимость между τ и ХВ имеет линейный характер
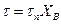 (14.16)
(14.16)
При проведении гетерогенной реакции в промышленном реакторе можно условно рассматривать каждую твердую частицу как самостоятельный микрореактор. Для увеличения производительности реактора нужно стремиться к уменьшению времени полного превращения твердой частицы τ п. При протекании гетерогенного процесса во внешнедиффузионной области это возможно при уменьшении радиуса частицы и повышении концентрации газообразного реагента СА,g, а также увеличении коэффициента массоотдачи. Последнее возможно, как это указывалось выше, при возрастании линейной скорости газа и турбулизации потока.
Процесс лимитируется внутренней диффузией.
Если гетерогенный процесс лимитируется внутренней диффузией, то на этой стадии сосредоточено основное сопротивление и, как следствие, концентрация газообразного реагента меняется от СА,g до нуля на пространстве от внешней оболочки частицы до ядра (рис. 14.4, б).
Скорость гетерогенного процесса в этом случае может быть приравнена к скорости диффузии через пористый слой твердых продуктов:
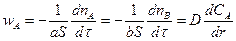 (14.17)
(14.17)
Поверхность S, к которой отнесена скорость гетерогенного процесса при лимитировании его внутренней диффузией, - при сферической форме частицы - это поверхность ядра с радиусом r:
S = 4πr2
Решение полученного уравнения будет иметь вид
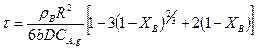 (14.18)
(14.18)
При XB = 1 уравнение (14.18) позволит рассчитать время полного превращения твердой частицы τ п при протекании гетерогенного процесса во внутренней диффузионной области:
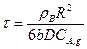 (14.19)
(14.19)
Таким образом, для внутренней диффузионной области некаталитического гетерогенного процесса
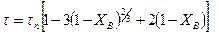 (14.20)
(14.20)
Принимая, что средняя толщина слоя продуктов реакции равна половине внешнего радиуса частицы, значение коэффициента массоотдачи на стадии внутренней диффузии
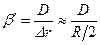 (14.21)
(14.21)
и уравнение (14.19) можно записать в таком виде
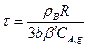 (14.22)
(14.22)
В таком виде уравнение для определения времени полного превращения твердой частицы при протекании гетерогенного процесса во внутренней диффузионной области аналогично уравнению (14.15), выведенному для внешнедиффузионной области.
Основной путь интенсификации гетерогенного процесса, протекающего во внутренней диффузионной области, – увеличение коэффициента массоотдачи β′. Этот коэффициент тем выше, чем больше коэффициент диффузии D и чем меньше толщина слоя продуктов реакции Δr. Коэффициент диффузии D слабо зависит от температуры и определяется характером пористой структуры частицы. Легче повлиять на величину Δr. Из уравнения (14.21) видно, что толщину слоя можно принять равной половине первоначального радиуса твердой частицы. Чем меньше размер частиц, тем меньше Δr и тем больше коэффициент β'.
Следовательно, чтобы уменьшить сопротивление внутренней диффузии, нужно измельчить твердый материал.
Процесс лимитируется химической реакцией.
Если стадии внешней и внутренней диффузии не оказывают сопротивления процессу (отсутствует диффузионное торможение), то на химическую реакцию не накладывается никаких дополнительных ограничений и скорость всего гетерогенного процесса зависит только от чисто кинетических факторов.
С учетом того, что при лимитировании химической реакцией
СА,с = СА,s = СА,g (рис. 14.4, в) получим:
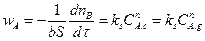
В частности, для поверхностной химической реакции первого порядка
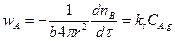 (14.23)
(14.23)
Количество молей вещества В в твердой частице можно представить как произведение объема этой частицы и молярной концентрации этого реагента (плотность распределения вещества в объеме частицы).
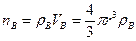
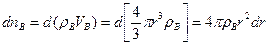 (14.24)
(14.24)
Заменив в уравнении (14.23) скорость расходования реагента dnB/dτ на скорость продвижения границы ядра dr/dτ, получим
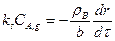 (14.25)
(14.25)
дифференциальное уравнение с разделяющимися переменными, которое при интегрировании примет вид:
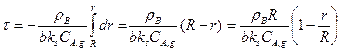 (14.26)
(14.26)
Заменим выражение r/R на (1-XB)1/3, при этом уравнение (14.26) примет вид
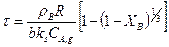 (14.27)
(14.27)
При конверсии ХВ = 1 из уравнения (14.27) получим время полного превращения твердой частицы, имеющей радиус R, при протекании
гетерогенного процесса в кинетической области:
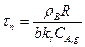 (14.28)
(14.28)
Таким образом, для кинетической области гетерогенного взаимодействия
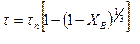 (14.29)
(14.29)
Величина τп в значительной степени определяет производительность и интенсивность работы реактора для проведения гетерогенного процесса и зависит от значений R и СА,g, входящих также и в уравнения (14.15) и (14.22) для расчета времени полного превращения твердых частиц при протекании процесса в диффузионных областях. Зависит она так же и от константы скорости поверхностной химической реакции ks. Увеличение ks приведет к резкому росту интенсивности процесса, протекающего в кинетической области. Так как ks зависит в основном от температуры, то наиболее целесообразным способом управления гетерогенным процессом, лимитируемым химической реакцией является именно изменение температуры.
Способы определения лимитирующей стадии.
Расчет реакторов для проведения гетерогенных процессов в системе «газ - твердое вещество» удобно вести, если известна лимитирующая стадия процесса, так как в этом случае зависимость между временем пребывания частицы в реакторе и степенью превращения твердого реагента выражается однозначными уравнениями (14.16), (14.20) или (14.29). Ясны и способы управления таким процессом. Поэтому важно определить лимитирующую стадию гетерогенного процесса.
Если известны коэффициенты массоотдачи β и β′, а также константа скорости ks, то, сравнивая их величины, можно определить, есть ли в данных условиях проведения гетерогенного процесса лимитирующая стадия, и если она есть, то какая именно. Лимитирующая стадия, как указывалось, обладает максимальным сопротивлением. Например, если процесс лимитируется внешней диффузией, то
1/β >> 1/β′ и 1/β >>1/ks
или
β << β′ и β << ks
Если же коэффициенты интенсивности разных стадий – величины одного порядка, то лимитирующей стадии нет, и тогда говорят, что гетерогенный процесс протекает в переходной области.
Однако чаще всего точные значения коэффициентов β, β′ и ks неизвестны, расчетные формулы, позволяющие их определить, отсутствуют или справедливы лишь для узкого интервала изменения параметров процесса. В связи с этим наиболее пригодны экспериментальные методы определения лимитирующей стадии. Эти методы можно условно разбить на две группы.
Методы, основанные на изучении влияния параметров гетерогенного процесса на его скорость.
Лимитирующую стадию можно экспериментально определить, изучая зависимость скорости гетерогенного процесса от температуры Т, линейной скорости газового потока u и степени измельчения 1/R (величина обратная среднему радиусу частиц).
Если гетерогенный процесс в некотором диапазоне изменения параметров его проведения (Т, и, размеры частиц) лимитируется химической реакцией, то скорость его определяется в основном константой скорости поверхностного химического взаимодействия. Константа скорости ks экспоненциально увеличивается с ростом температуры, в то время как коэффициенты массоотдачи на диффузионных стадиях β и β′ зависят от температуры лишь очень слабо (~ Т0,5). Следовательно, если при постоянстве линейной скорости потока и и размера частиц R с увеличением температуры наблюдается резкий рост скорости процесса, то он протекает в кинетической области.
Кинетическая область характерна для сравнительно низких температур проведения процесса.
Если при изучении влияния температуры на скорость гетерогенного процесса окажется, что интересующий нас температурный интервал совпадает с диффузионной областью, нужно решить, какая диффузионная стадия (внешняя или внутренняя диффузия) является лимитирующей.
Скорость конвективной диффузии (внешней) очень сильно зависит от гидродинамической обстановки. Следовательно, увеличение линейной скорости газового потока относительно твердых частиц при неизменных R и Т приведет к резкому возрастанию скорости процесса, если он лимитируется внешней диффузией.
Скорость внутренней диффузии должна резко увеличиться в случае измельчения твердой фазы (так как β′ = D/(R/2)). Если изучение влияния температуры и линейной скорости потока не позволило определить лимитирующую стадию, а измельчение твердого материала вызвало существенный рост скорости гетерогенного процесса, то это значит, что он лимитируется диффузией в поры твердого вещества (протекает во внутренней диффузионной области).
Методы, основанные на сравнении экспериментальных и теоретических зависимостей Хв(τ).
Эта группа методов основана на сравнении экспериментально полученной кинетической зависимости степени превращения твердого реагента от времени пребывания в реакторе и теоретических зависимостей ХВ(Δτ) рассчитанных для разных областей протекания гетерогенного процесса.
Теоретические зависимости имеют вид:
a) для внешнедиффузионной области
ХВ = τ/τп (14.30)
b) для кинетической области
ХВ = 1-(1- τ/τп)3 (14.31)
c) для внутренней диффузионной области зависимость определяется функцией заданной в неявном виде
1- τ/τп = 3(1-ХВ)2/3 – 2(1-ХВ) (14.32)
По расчетным и экспериментальным зависимостям строятся соответствующие кривые, которые позволяют на основании статистических расчетов отдать предпочтения той или иной модели.
Существуют и другие методы определения лимитирующей стадии гетерогенного процесса.
 2015-04-17
2015-04-17 12292
12292