Большинство химических реакций, используемых в технологических процессах, протекает с участием веществ, находящихся в разных фазах. В зависимости от того, в каких фазах находятся участники реакции, различают двух- и трехфазные системы. Несмотря на специфические различия между ними, все они объединены одним общим признаком; прежде чем произойдет химическая реакция, реагенты из ядра потока одной фазы должны перейти к поверхности раздела фаз или в объем другой фазы.
Общие особенности
Для гомогенных реакций, в частности для реакций в жидкой фазе, диффузионные процессы переноса вещества из одной точки реакционного пространства в другую, особенно при больщих размерах реактора, играют определенную роль, но обычно они протекают с достаточно большой скоростью и существенно не влияют на скорость химического взаимодействия. Для гетерогенных процессов учет скорости переноса вещества от фазы к фазе значительно более важен из-за затрудненности этой стадии. Зачастую скорость гетерогенного процесса определяется не скоростью химической реакции, а именно скоростью процессов переноса.
Гетерогенные процессы протекают, как правило, на поверхности раздела фаз. При этом гетерогенными могут быть и такие процессы, в которых все исходные реагенты и продукты реакции находятся в одной фазе. Так, например, синтез аммиака из газообразных азота и водорода протекает на поверхности железа (твердого катализатора, в основе которого металлическое железо), поэтому этот процесс также является гетерогенным.
Характерной чертой любого гетерогенного процесса является его многостадийность – обязательное наличие наряду с одной или несколькими чисто химическими стадиями (т.е. одной или несколькими химическими реакциями) стадии, которые можно было бы назвать физическими (в том смысле, что при их протекании не происходит химических превращений). Эти стадии связаны с переносом вещества от одной фазы к другой, причем концентрация вещества в разных фазах (или же в ядре фазы и на поверхности раздела) различна. Разность концентраций является движущей силой диффузионных процессов переноса.
При протекании гетерогенных процессов собственно химическая стадия может представлять собой как гетерогенную, так и гомогенную химическую реакцию. Например, гетерогенным будет взаимодействие кислорода с сульфидами металлов при обжиге различных сульфидных руд. Однако реакция окисления молекулярным кислородом жидких углеводородов протекает как гомогенная, хотя реагенты и находятся в разных фазах, так как в химическую реакцию вступает не газообразный, а растворенный кислород. Гетерогенной в этом случае будет не химическая реакция, а предшествующая ей диффузионная стадия растворения кислорода.
Итак, гетерогенные процессы многостадийны. В общем случае скорости отдельных стадий, составляющих гетерогенный процесс, могут существенно различаться и по-разному зависеть от изменения параметров технологического режима. Например, температура неодинаково влияет на скорости химической реакции и переноса веществ вследствие диффузии.
Если сложный процесс состоит из параллельных стадий, его скорость равна сумме скоростей этих стадий:
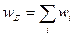
Взаимосвязь между скоростями отдельных стадий и общей скоростью процесса, состоящего из нескольких последовательных стадий, различна для нестационарного и стационарного режимов протекания этого процесса.
Скорости последовательных стадий в нестационарном режиме различаются между собой, а скорость процесса в целом равна скорости самой медленной стадии.
В стационарном режиме скорости отдельных последовательных стадий «подстраиваются» под скорость самой затрудненной стадии; они равны между собой и равны общей скорости процесса:
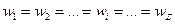 (14.1)
(14.1)
В различных моделях гетерогенные процессы рассматриваются как состоящие из последовательных или последовательных и параллельных стадий.
Скоростью гетерогенного химического процесса называют количество одного из реагентов или продуктов реакции, которое прореагирует или образуется в единицу времени на единице поверхности раздела фаз.
Скорость гетерогенного процесса по компоненту J определяется уравнением
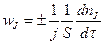 (14.2)
(14.2)
где j – стехиометрический коэффициент реагента (или продукта) J;
S – площадь реакционной поверхности.
Чтобы можно было сравнивать скорости отдельных стадий гетерогенного процесса и всего процесса в целом, все они должны быть выражены одинаково. Следовательно, скорость химической стадии wrJ будем определять в соответствии с выражением (14.2) и скорость диффузионных стадий wDJ также будем определять как количество вещества J, перенесенное в единицу времени через единицу поверхности раздела фаз.
Иногда скорость гетерогенной химической реакции определяют количеством вещества, вступившего в реакцию или образовавшегося в результате реакции в единицу времени (т.е. как dnJ / dτ). Это определение совпадает с понятием производительности. Производительность реактора тем выше, чем больше размер реакционного пространства; в данном случае она пропорциональна поверхности раздела фаз.
Для описания скорости гетерогенного процесса будем использовать лишь уравнение (14.2) (иногда такую скорость называют удельной). В соответствии с ним скорость не зависит от размеров общей поверхности раздела фаз.
Так как конечный результат любого химико-технологического процесса – это образование продукта в результате химического превращения, то скорость гетерогенного процесса в любом случае не может быть выше скорости химической реакции. Действительно, как бы быстро ни переносилось вещество от одной фазы к другой, сам по себе этот перенос еще не приводит к образованию продукта.
Однако скорость гетерогенного процесса не может быть больше и скорости диффузионного переноса вещества, так как он предшествует химической реакции.
При анализе гетерогенных процессов выделяют две крайние, принципиально различающиеся ситуации. В первом случае может оказаться, что скорость химической реакции велика и превышает скорость диффузионных стадий. Тогда для увеличения производительности и интенсификации процесса нужно стремиться к устранению тормозящего влияния диффузионных стадий. Этот случай соответствует диффузионной области протекания гетерогенного процесса.
Другая ситуация характеризуется тем, что скорость химической реакции при данном режиме осуществления процесса мала по сравнению со скоростью диффузионных стадий. Интенсификация гетерогенного процесса в целом может быть достигнута при таком изменении технологического режима, которое приведет к интенсификации химической стадии. Такие гетерогенные процессы принято называть процессами, протекающими в кинетической области.
 2015-04-17
2015-04-17 6354
6354







