2.1 Основные свойства газовых смесей
В практике гораздо чаще приходится встречаться не с чистыми газами, а с их смесями. Как известно, газовыми смесями называются механические смеси индивидуальных газов при условии отсутствия в них химических реакций. Если температура и давление одинаковы во всем объеме газа, то считается, что газовая смесь находится в равновесном состоянии. Смесь, состоящая из газов без веществ в конденсированном (жидком или твердом) состоянии, называется гомогенной.
Необходимыми исходными данными для расчета теплофизических свойств гомогенной смеси являются равновесное состояние, сведения о теплофизических свойствах индивидуальных газов и об объемном, массовом или молярном составах смеси.
Поведение реальных газовых смесей строго не подчиняются уравнению состояния идеальных газов. Поэтому для расчета ряда теплофизических параметром реальных газовых смесей широко используются эмпирические формулы. Некоторые же теплофизические характеристики могут успешно определяться по уравнениям, составленным для идеальных газовых смесей, подчиняющихся уравнению Клапейрона, законам Авогадро, Дальтона, Амага.
|
|
|
Для проведения расчетов по газовым смесям необходимо установить следующие основные параметры, характеризующие их состояние:
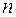 - число индивидуальных газов в смеси;
- число индивидуальных газов в смеси;
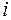 - 1, 2, …,
- 1, 2, …, 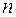 - номер индивидуального газа (компонента);
- номер индивидуального газа (компонента);
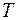 - термодинамическая температура смеси в
- термодинамическая температура смеси в 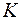 ;
;
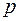 - абсолютное давление смеси в
- абсолютное давление смеси в 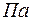 ;
;
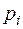 - парциальное давление
- парциальное давление 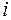 –го компонента в смеси в
–го компонента в смеси в 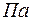 ;
;
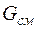 - масса газовой смеси в
- масса газовой смеси в 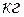 ;
;
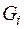 - масса
- масса 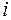 –го компонента смеси в
–го компонента смеси в 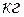 ;
;
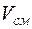 - объем газовой смеси в
- объем газовой смеси в 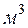 ;
;
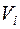 - приведенный объем
- приведенный объем 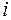 –го компонента смеси в
–го компонента смеси в 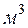 ;
;
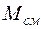 - количество молей всех газов в смеси в
- количество молей всех газов в смеси в 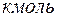 ;
;
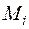 - количество молей
- количество молей 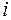 –го компонента смеси в
–го компонента смеси в 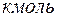 .
.
По закону Дальтона давление смеси идеальных газов равно сумме парциальных давлений индивидуальных газов:
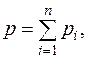
т. е. каждый газ в смеси находится под своим парциальным давлением.
По закону Амага сумма приведенных объемов равна объему смеси:
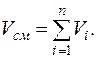
Состав смеси может быть задан массовыми 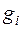 , объемными
, объемными 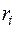 или молярными
или молярными 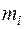 долями компонентов.
долями компонентов.
Массовая доля 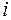 –го компонента газовой смеси представляет собой отношение массы
–го компонента газовой смеси представляет собой отношение массы 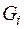
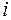 –го компонента к массе
–го компонента к массе 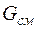 всей смеси:
всей смеси:
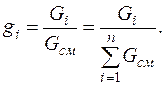
Сумма массовых долей компонентов смеси равна единице:
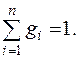 (3)
(3)
Объемная доля 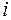 –го компонента газовой смеси определяется отношением приведенного объема
–го компонента газовой смеси определяется отношением приведенного объема 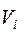
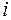 –го компонента к объему
–го компонента к объему 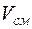 , занимаемому всей смесью:
, занимаемому всей смесью:
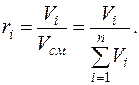
Сумма объемных долей компонентов смеси равна единице:
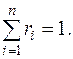 (4)
(4)
Молярная доля 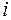 –го компонента газовой смеси определяется отношением количества молей
–го компонента газовой смеси определяется отношением количества молей 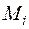
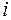 –го газа к общему количеству молей
–го газа к общему количеству молей 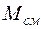 всех газов смеси:
всех газов смеси:
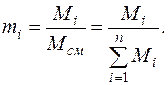
Сумма молярных долей компонентов смеси равна единице т.е.
|
|
|
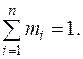
Количество молей i –го компонента в газовой смеси определяется следующим соотношением
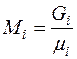
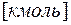 ,
,
где 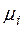 - молярная масса
- молярная масса 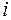 –го компонента в
–го компонента в 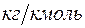 .
.
Из закона Авогадро следует, что
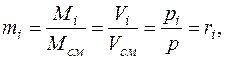 (5)
(5)
т. е. молярные и объемные доли численно равны и состав смеси можно задавать также через парциальные давления компонентов.
Между массовыми и объемными (молярными) долями существуют следующие соотношения:
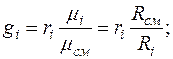
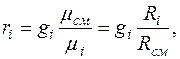
где 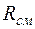 - газовая постоянная смеси в
- газовая постоянная смеси в 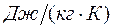 ;
;
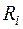 - газовая постоянная
- газовая постоянная 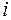 -го компонента в
-го компонента в 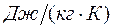 .
.
Часто на практике массовые, объемные (молярные) доли компонентов выражаются не в долях единицы, а в процентах.
 2015-04-01
2015-04-01 1795
1795
