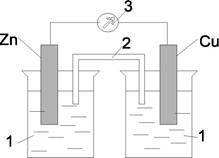
Примером может служить гальванический элемент Даниэля-Якоби (рис. 9.1). Он состоит из медной пластины, погруженной в раствор сульфата меди, и цинковой пластины, погруженной в раствор сульфата цинка 1. На поверхности цинковой пластинки под действием раствора ZnSO4 возникает электродный потенциал и устанавливается равновесие:
Zn ?=> Zn2+ + 2ē
|
ZnS04 CUSO4
Рис. 9.1. Гальванический элемент Даниэля-Якоби
| Стандартный электродный потенциал цинкового электрода имеет зна- 0 0 = +0,34 В, следова- |
| Е0 Cu2+/Cu |
чение E0 2+ = –0,76 В, а медного электрода
Zn /Zn
тельно, цинк более активен, чем медь. Поэтому при замыкании цепи солевым мостиком 2 и при соединении цинка с медью металлическим проводником 3, электроны будут переходить от цинка к меди. В результате этого равновесие на цинковом электроде сместится вправо, и в раствор перейдет дополнительное количество ионов цинка. В то же время равновесие на медном электроде сместится влево и произойдет разрядка ионов меди из раствора CuSO4 на медном электроде.
Таким образом, возникают самопроизвольные процессы растворения цинка на цинковом электроде, который становится анодом (–)А, и выделения меди на медном электроде, который становится катодом (+)К:
(–)А Zn0 – 2ē → Zn2+ - процесс окисления,
(+)К Cu2+ + 2ē → Cu0 - процесс восстановления.
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами.
Процессы восстановления получили название катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами.
Суммируя электродные процессы, получаем уравнение реакции:
Zn + Cu2+ = Cu + Zn2+
Вследствие этой химической реакции в гальваническом элементе происходит движение электронов во внешней цепи от анода (Zn) к катоду (Cu),
В Химия. Учеб. пособие
-133-
 2015-04-01
2015-04-01 510
510








