Молярная электрическая проводимость раствора l - мера электрической проводимости всех ионов, образующихся при диссоциации 1 моля электролита при данной концентрации. Она численно равна электрической проводимости такого объёма V (м3) раствора, который заключен между двумя параллельными электродами, с межэлектродным расстоянием 1м, причём каждый электрод имеет такую площадь, чтобы в этом объёме содержался 1 моль растворённого вещества. Между молярной и удельной электрическими проводимостями имеется соотношение
l = æ V = æ с, (2.4)
где l – молярная электрическая проводимость, См×м2моль; æ – удельная электрическая проводимость; См м; V – разведение раствора, м3 моль; с – концентрация раствора электролита, моль м3.
Если концентрация раствора выражена в мольл, т.е. моль/дм3, то уравнение (2.4) записывается в виде:
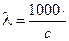 æ. (2.5)
æ. (2.5)
Молярная электрическая проводимость прямо пропорциональна абсолютным скоростям движения ионов (u + , u -):
l = a·F (u ++ u -). (2.6)
Абсолютной скоростью движения иона называется его скорость при градиенте потенциала в 1 В/·м, её размерность [ иi ] = В·м2·с-1.
Общий характер изменений молярной электрической проводимости с концентрацией для сильных и слабых электролитов выражен кривыми, представленными на рис.2.
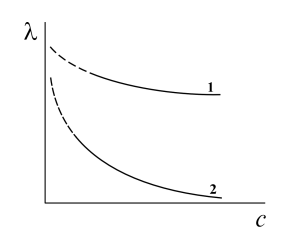 Рис.2. Зависимость молярной электрической проводимости растворов сильных (1) и слабых (2) электролитов от их концентрации. Рис.2. Зависимость молярной электрической проводимости растворов сильных (1) и слабых (2) электролитов от их концентрации. |
С увеличением разведения, т.е. с уменьшением концентрации раствора, молярная электрическая проводимость возрастает и в области разведений стремится к предельному значению l¥ .
Эта величина отвечает электрической проводимости гипотетического бесконечно разбавленного раствора, характеризующегося полной диссоциацией электролита (a=1) и отсутствием сил электростатического взаимодействия между ионами.
В соответствии с (2.6) молярная электрическая проводимость бесконечно разбавленного раствора будет выражаться уравнением:
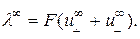 (2.7)
(2.7)
Произведение 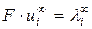 называется предельной молярной электрической проводимостью иона или подвижностью иона. Уравнение (2.7) можно записать в виде:
называется предельной молярной электрической проводимостью иона или подвижностью иона. Уравнение (2.7) можно записать в виде:
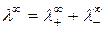 . (2.8)
. (2.8)
Предельная молярная электрическая проводимость является специфической величиной для данного вида ионов и зависит только от природы растворителя и температуры.
Величина молярной электрической проводимости бесконечно разбавленного раствора электролита представляет собой сумму двух независимых слагаемых, каждая из которых соответствует определённому виду ионов, т.е. сумму подвижностей ионов при предельном разбавлении. Это соотношение установлено Кольраушем и называется законом независимого движения ионов. Величина молярной электрической проводимости определяется по подвижностям ионов, которые приведены в справочнике.
Подвижности большинства ионов примерно одинаковы, кроме ионов H3O+ и OH-, которые обладают очень высокими абсолютными скоростями. Причиной этого явления является эстафетный механизм перемещения этих ионов в растворе от одной молекулы растворителя к другой.
 2015-04-01
2015-04-01 873
873








