Газовые электроды выделяют по признаку того, что один из участников окислительно-восстановительной пары находится в газовой фазе.
Примеры,
H+(aq) | H2(г) | Pt(т) — водородный электрод;
Cl–(aq) | Cl2(г) | Pt(т) — хлорный электрод.
Примером газового электрода является, например, водородный электрод H+½ H2,Pt, на котором протекает реакция
H+ +e = 1/2H2.
Электродный потенциал водородного электрода зависит от относительного давления газа водорода:
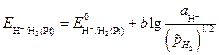 . (3.29)
. (3.29)
В водородной шкале потенциалов значение 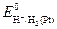 принято равным нулю.
принято равным нулю.
На газовом хлорном электроде Cl-½Cl2, Pt протекает реакция:
Cl2 + e= Cl- - е- = 1/2 Сl2,
и электродный потенциал равен:
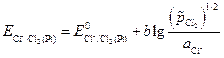 . (3.30)
. (3.30)
Как видно из приведенных выше электрохимических реакций, протекающих на электродах первого рода, одной из форм (окисленной или восстановленной) является простое соединение (атомы металла, неметалла или молекулы газа), а другой формой – ионы этого соединения.
 2015-04-01
2015-04-01 2003
2003








