Гальванические элементы первого типа – химические цепи представляют собой элементы, составленные из электродов, на которых протекают различные электрохимические реакции.
В основе работы всякого электрохимического элемента лежат самопроизвольные окислительно-восстановительные реакции, протекающие раздельно: на более отрицательном электроде (аноде) — окисление, на более положительном (катоде) — восстановление.
Соединение электродов внешним проводником приводит к появлению в цепи электрического тока. Например, элемент Даниэля — Якоби составлен из двух электродов первого рода цинкового и медного. Последовательность соединения их изображают схемой:
Cu | Zn | ZnSO4(aq) ¦ CuSO4(aq) | Cu.
(1) Cu2+(aq) + 2 e–  Cu;
Cu;
(2) Zn2+(aq) + 2 e–  Zn.
Zn.
Суммарная реакция, протекающая в элементе
Zn + Cu2+(aq)  Cu + Zn2+(aq).
Cu + Zn2+(aq).
ЭДС этого элемента
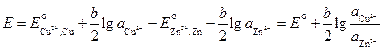 , (3.34)
, (3.34)
где 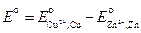 .
.
Различают химические цепи с двумя и с одним электролитом. К электрохимическим элементам с двумя электролитами относятся рассмотренный выше элемент Даниэля — Якоби.
Химические цепи с одним электролитом могут быть двух видов.
В цепях первого вида один электрод обратим относительно катиона, другой — относительно аниона. Например, элемент
Cd | CdCl2(aq) | AgCl | Ag
Он используется для определения среднего коэффициента активности электролита CdCl2. Рассчитаем ЭДС этого элемента.
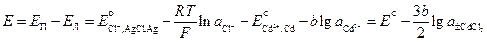 , (3.35)
, (3.35)
где 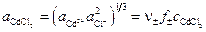 – средняя активность раствора CdCl2.
– средняя активность раствора CdCl2.
В гальванических элементах второго вида (с одним электролитом) оба электрода обратимы относительно одного из ионов. Примером может служить элемент
Hg | Hg2Cl2 | KCl (aq) | Cl2(г) | Pt
Выражение для ЭДС этого элемента равно:
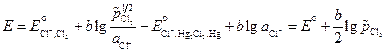 . (3.36)
. (3.36)
Если создать условия, при которых 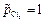 , то ЭДС этого элемента будет равна стандартной ЭДС. Такого типа гальванические элементы используются для точного определения стандартной электродвижущей силы (Еº) элемента.
, то ЭДС этого элемента будет равна стандартной ЭДС. Такого типа гальванические элементы используются для точного определения стандартной электродвижущей силы (Еº) элемента.
 2015-04-01
2015-04-01 1098
1098
