Пример 1. Укажите знаки электродов и их тип, напишите уравнения анодного и катодного процессов, суммарные ионно-молекулярное и молекулярное уравнения процессов, протекающих в гальваническом элементе, схема которого:
Ni½NiSO4 aq║ CoSO4 aq½Co.
Вычислите ЭДС этого элемента, если а 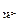 = 0,001 М, а
= 0,001 М, а 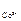 = 1 М. Стандартные потенциалы электродов соответственно равны:
= 1 М. Стандартные потенциалы электродов соответственно равны: 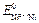 = – 0,25 В;
= – 0,25 В; 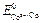 = – 0,28 В. Будет ли такой элемент работать самопроизвольно?
= – 0,28 В. Будет ли такой элемент работать самопроизвольно?
Решение.
1. Так как стандартный потенциал электрода 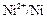 более положительный, чем у электрода
более положительный, чем у электрода 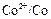 , знаки у электродов такие:
, знаки у электродов такие:
(+) Ni½NiSO4 aq║ CoSO4 aq½Co (–).
Это электроды первого рода.
2. На электроде, имеющем более положительный потенциал (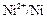 ), происходит отдача электронов, то есть процесс окисления. Этот электрод называется анодом.
), происходит отдача электронов, то есть процесс окисления. Этот электрод называется анодом.
На электроде, имеющем более отрицательный потенциал (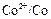 ), происходит принятие электронов, то есть процесс восстановления. Этот электрод называется катодом.
), происходит принятие электронов, то есть процесс восстановления. Этот электрод называется катодом.
Процессы, протекающие на электродах в гальваническом элементе:
Анод 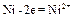 ;
;
Катод 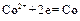 .
.
_______________________________
Ионно-молекулярное уравнение: 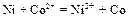 .
.
Молекулярное уравнение: 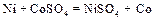 .
.
3. ЭДС элемента равна:
Е = Е+ – Е- = 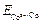 –
– 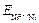 .
.
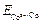 =
= 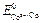 +
+ 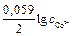 = – 0,28 + (0,059/2)lg1= – 0,28 В.
= – 0,28 + (0,059/2)lg1= – 0,28 В.
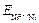 =
= 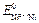 +
+ 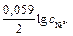 = – 0,25 + (0,059/2)lg0,001= – 0,34 В.
= – 0,25 + (0,059/2)lg0,001= – 0,34 В.
Е = – 0,28 – (– 0,34)= 0,06 В.
Так как ЭДС элемента положительная величина, то элемент работает самопроизвольно, так как 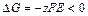 .
.
Пример 2. М ожет ли самопроизвольно протекать реакция
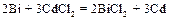
Составьте схему гальванического элемента, в котором протекает эта реакция. Напишите уравнения анодного и катодного процессов, а также суммарное ионно-молекулярное и молекулярное уравнения. Определите ЭДС этого элемента при активности ионов в растворе, равных 1.
Решение.
1. Составим гальванический элемент из двух электродов первого рода 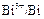 и
и 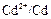 . Согласно литературным данным
. Согласно литературным данным 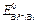 = +0,22 В, а
= +0,22 В, а 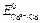 = – 0,40 В, поэтому схема гальванического элемента имеет вид:
= – 0,40 В, поэтому схема гальванического элемента имеет вид:
Cd½ CdCl2 (aq) || BiCl2 (aq) Bi.
2. В гальваническом элементе на отрицательном электроде (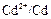 ) протекает реакция окисления кадмия, а на положительном электроде (
) протекает реакция окисления кадмия, а на положительном электроде (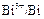 ) процесс восстановления иона висмута:
) процесс восстановления иона висмута:
(–) 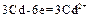 ;
;
(+) 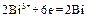 .
.
Ионно-молекулярное уравнение: 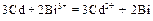 .
.
Молекулярное уравнение: 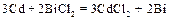 .
.
3. Так как активности ионов равны единицы, то электродные потенциалы будут равны стандартным электродным потенциалам. ЭДС элемента равна:
Е = 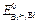 –
– 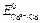 = +0,22 – (-0,40) = + 0,62 В > 0.
= +0,22 – (-0,40) = + 0,62 В > 0.
Dr G = – zFЕ. Следовательно, Dr G > 0 и рассматриваемая реакция
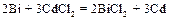
может протекать самопроизвольно.
Пример 3. Вычислить при 298 К ЭДС следующего элемента:
Zn ½ZnCl2aq ║ СdCl2 aq ½Cd
C¢ =0,005 М С²=2 М
Стандартные потенциалы электродов Cd2+½Cd и Zn2+½Zn соответственно равны (– 0,402) и (– 0,763) В. Средние коэффициенты активности CdCl2 и ZnCl2 в растворах указанных концентраций равны 0,044 и 0,789. Можно ли за счет изменения концентрации ионов кадмия и цинка в растворах изменить направление тока в элементе?
Решение.Имеется электрохимический элемент, составленный из двух разных электродов первого рода. Сравнивая значения стандартных электродных потенциалов этих электродов, видим, что цинковый электрод в этой цепи электрод отрицательный (Е0= – 0,763 В), а кадмиевый – положительный (Е0 = – 0,402 В).
На электродах протекают реакции:
(–) Zn = Zn2++2 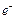 ,
,
(+) Cd2+ +2 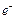 =Cd.
=Cd.
Суммарная реакция, протекающая при работе электрохимического элемента:
Zn + Cd2+ = Zn2+ + Cd.
Значения потенциалов каждого электрода равны:
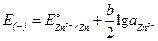 ;
;
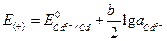 .
.
Значение ЭДС элемента равно:
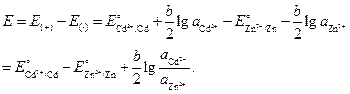
Подставим численные значения, учитывая, что активности ионов равны средней активности э соответствующих электролитов
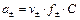 ;
; 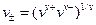 .
.
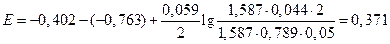 В,
В,
где 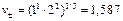 .
.
Для изменения направления тока в элементе, нужно, чтобы Е(–) стало больше Е(+), т. е. чтобы Е стало отрицательным. Вычислим вначале, при каком отношении активностей ионов кадмия и цинка в растворе потенциалы электродов станут равными. В этом случае ЭДС примет значение, равное нулю.
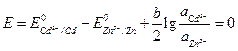 .
.
Отсюда:
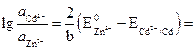
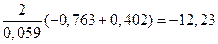 .
.
Следовательно:
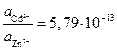 или
или 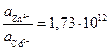 .
.
Результат расчета показывает, что изменением концентраций не может быть достигнуто даже равенство потенциалов, поскольку активность ионов цинка должна быть более чем в 1012 раз больше активности ионов кадмия в растворе. Такие условия практически невозможно реализовать.
Пример 4. Разбавленный раствор FеС13 в 0,5 М НС1 (f±HCl = +0,757) взбалтывается с ртутью (при 298 К), при этом протекает реакция
Fe3+ + Hg + Cl- = Fe2+ + 1/2 Hg2Cl2
Определите отношение активностей 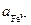 /
/ 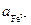 после установления равновесия в данной реакции, если стандартные потенциалы электродов Cl–/Hg2Cl2, Hg и
после установления равновесия в данной реакции, если стандартные потенциалы электродов Cl–/Hg2Cl2, Hg и
Fe3+, Fe2+/Pt относительно стандартного водородного электрода равны 0,268 и 0,771 В.
Решение. Составим электрохимический элемент, в котором бы протекала требуемая по условию реакция. Выберем каломельный и окислительно‑восстановительный железный электроды. По числовым значениям стандартных электродных потенциалов делаем вывод, что отрицательным будет каломельный электрод, а положительным – железный окислительно‑восстановительный. Запишем цепь:
(–) Hg, Hg2CI2 | Cl– || Fe3+, Fe2+ | Pt (+)
Электродные реакции, проотекающие в этом электрохимическом элементе
(–) Hg + Cl- = 1/2 Hg2Cl2 + е-
(+) Fe3+ + е- = Fe2+
и суммарную реакцию, протекающую при работе составленного нами электрохимического элемента,
Hg + Fe3++ Cl- = Fe2+ + ½ Hg2Cl2.
Сравнивая эту реакцию с реакцией, указанной по условию задачи и протекающей в колбе при взбалтывании FеС1з в НС1 с ртутью, делаем вывод, что реакции идентичны.
Запишем выражения для электродных потенциалов и ЭДС элемента:
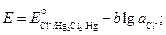
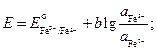
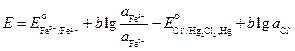 .
.
По условию задачи требуется найти отношение активностей ионов железа после установления равновесия. Учтем, что электрохимический элемент работает до наступления равновесия, при этом ЭДС становится равной нулю:
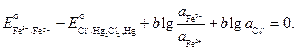
Выразим отсюда отношения активностей ионов железа:
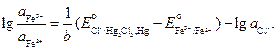
Учитывая, что активность хлорид-ионов равна средней активности хлороводорода
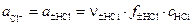 ,
,
имеем
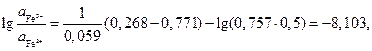
где 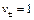 для HCl. Отсюда
для HCl. Отсюда
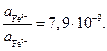
Вопросы для самоконтроля
1. Дайте определение термина стандартный электродный потенциал и объясните причину возникновения разности потенциалов между каким-либо металлом и раствором одной из его солей.
2. В химическом источнике тока
Pt½Fe+2, Fe+3 ║ Ag+ ½ Ag
протекает реакция:
Fe+2(раств)+ Ag+(раств)= Fe+3(раств)+ Ag(тв).
Какое влияние (увеличение, уменьшение или отсутствие эффекта) должны оказать на напряжение источника тока следующие изменения:
а) увеличение концентрации Fe+3(раств);
б) одновременное увеличение концентрации Fe+3(раств) и Fe+2(раств) в одинаковое число раз;
в) добавление твердого серебра;
г) добавление некоторого количества NaCl в раствор, где имеются ионы серебра.
3. Как определить направление самопроизвольного химического превращения при протекании процессов в электрохимическом элементе? Дайте обоснованный ответ, в каком направлении будет протекать самопроизвольно реакция: 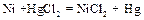
4.Объясните, какой смысл имеют разделяющие знаки (½и║) в схематической записи химического источника тока:
Zn ½ZnSO4aq ║ CuSO4aq½Cu
Укажите, где в этой схеме анод, а где катод? Объясните смысл терминов анод и катод и укажите на схеме направление потока электронов во внешней цепи.
5. Что должно произойти при введении ионов 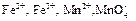 (в виде солей) в раствор, в котором содержится избыток разбавленной серной кислоты? Для объяснения воспользуйтесь значениями стандартных окислительно-восстановительных потенциалов электродов:
(в виде солей) в раствор, в котором содержится избыток разбавленной серной кислоты? Для объяснения воспользуйтесь значениями стандартных окислительно-восстановительных потенциалов электродов: 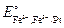 = 0,76 В;
= 0,76 В; 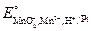 =1,52 В.
=1,52 В.
 2015-04-01
2015-04-01 4894
4894
