Кинетические уравнения реакций первого, второго, третьего порядков можно записать в виде уравнений прямых линий в соответствующих координатах:
ln C = ln C 0 – kI×t; 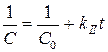 ;
; 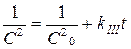 . (4.60)
. (4.60)
Если, например, опытные точки расположились на прямой линии на графике в координатах ln C – t, а на других графиках получались кривые, то это указывает на то, что рассматриваемая реакция имеет порядок по данному веществу, равный единице. По угловому коэффициенту этой прямой можно определить константу скорости реакции.
2. Определение порядка реакции по периоду полупревращения (полураспада) (метод Оствальда – Нойеса).
Метод основан на определении времени, в течение которого концентрация или количества исходных веществ в ходе реакции уменьшаются в два раза (Сх=С 0/2).
 2015-04-01
2015-04-01 565
565








