| ВЕЩЕСТВО | ||||
| агрегатное состояние | состав | |||
| газообразное | жидкое | твёрдое | простые | сложные |
| формы нет, объема нет, расширяется и сжимается | формы нет, объем есть, сжимается плохо | форма есть, объем есть, сжимается плохо | из атомов одного элемента. Например: О2, Н2 | из атомов разных элементов. Например: Н2O, НСl |
Химический элемент – определенный вид атомов с одинаковым положительным зарядом ядра.
Аллотропия – это явление, при котором один элемент образует простые вещества с разными свойствами. Например, О – кислород, озон: С – графит, алмаз, карбин.
| Относительная атомная масса, у.е. | Относительная молекулярная масса, у.е. |
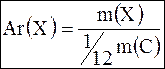 ,
где m(X) – средняя масса атома элемента ,
где m(X) – средняя масса атома элемента 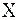 ,
m(C)– масса атома углерода. ,
m(C)– масса атома углерода.
| 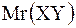 = =  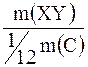 = = 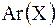 + + 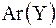 ,
где m(XY) – масса молекулы,
Ar(X), Ar(Y)– относительные атомные массы элементов X, Y. ,
где m(XY) – масса молекулы,
Ar(X), Ar(Y)– относительные атомные массы элементов X, Y.
|
| Например: Ar(O) = 15,9994 Ar(H) = 1,0079 | Например: Mr(H2О) = 2 Ar(Н) + Ar(О) = 2∙1,0079+ + 15,9994 = 18,01 |
Моль – это количество вещества, содержащее столько же структурных единиц (молекул, атомов, ионов), сколько атомов содержится в 12 г углерода 12С.
| Число структурных единиц вещества | |
где NA – число Авогадро, число частиц в одном моле: NA = 6,02·1023 моль–1, n(x) – количество вещества(моль). |
Молярная масса, г/моль
или M(x)=Mr(x), где M(x) – (г/ моль), m(x) – масса вещества(грамм), n(x) – количество вещества(моль). | |
Молярный объем
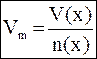 ,
где Vm – молярный объем газа(л/моль),
V(x) – объем(литр),
n(x) – количества вещества(моль). ,
где Vm – молярный объем газа(л/моль),
V(x) – объем(литр),
n(x) – количества вещества(моль).
|
| Относительная плотность – D | |
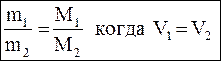 ,
где m1 – масса определенного объема первого газа,
m2 – масса такого же объема второго газа, ,
где m1 – масса определенного объема первого газа,
m2 – масса такого же объема второго газа,
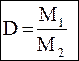 , отсюда М1 = D∙M2
где М1, М2 – молекулярные массы 1 и 2 газа с одинаковым объемом и взятые в одинаковых условиях. , отсюда М1 = D∙M2
где М1, М2 – молекулярные массы 1 и 2 газа с одинаковым объемом и взятые в одинаковых условиях.
| |
| Например: при D(Н2) = 8 и М2(Н2) = 2 г/моль, молярная масса газа равна: М1 = D(Н2) • M2(Н2) = 8 • 2 = 16 г/моль; при D(воздух) = 1,517 и М2(воздух) = 29 г/моль, молярная масса газа равна: М1 = D(воздух) • M2(воздух) = 1,517 • 29 = 44 г/моль; | |
| Соединения | |
| Дальтониды– соединения молекулярной структуры; состав постоянный независимый от способа получения. | Бертоллиды –соединения с немолекулярной структурой (с атомной, ионной и металлической решёткой);переменного состава, который зависит от способа получения. |
| Например: Н2О, HCl, CCl4, CO2 Состав: СO2=27,27%(C)+72,73%(O) независимо от способа получения. | Например: UO3 → состав от UO2,5 до UO3; UO → состав от UO0,9 до UO1,3. Зависит от температуры и давления кислорода. |
Химические реакции – явления, при которых одни вещества превращаются в другие, отличающиеся от исходных составом и свойствами, при этом не происходит изменения состава ядер атомов.
При физических явлениях изменяется форма, физическое состояние или образуются новые вещества за счет изменения состава ядер атомов.
| Классификация химических реакций | по признаку | выделения или поглощения теплоты | экзотермические H2+Cl2 = 2HCl; ∆H˚ = –184,6 кДж; |
| эндотермические N2+O2 = 2NO; ∆H˚= 180,8 кДж; | |||
| изменения числа исходных и конечных веществ соединения | соединения HCl+NH3=NH4Cl; | ||
| разложения 2HI = H2+I2; | |||
| обратимости реакции | обратимые N2+3H2 ↔ 2NH3; | ||
| необратимые 2KClO3 → 2KCl+3O2; | |||
| изменения степени окисления атомов | без изменения BaCl2+H2SO4→BaSO4+2HCl; | ||
| окислительно-восстановительные 0 +5 +2 +4 Cu+4HNO3→Cu(NO3)2+2NO2+2H2O. |
1.2. Законы химии
| Закон Бойля-Мариотта При постоянной температуре PV = const где Р – давление, V – объем. | Закон Гей-Люссака
При постоянном давлении
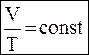 ,
где Т – температура (К),
V – объем. ,
где Т – температура (К),
V – объем.
|
Объединенный газовый закон 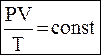
| |
Для решения задач 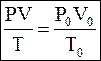 ,
где Р0, V0, T0 – давление, объем и температура газа при нормальных условиях. ,
где Р0, V0, T0 – давление, объем и температура газа при нормальных условиях.
| |
| Нормальные условия Р0 = 101325 Па, Т0 = 273 К | |
Уравнение Менделеева-Клайперона
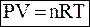 или или 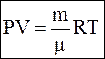 ,
где P – давление газа (Па)
V – объем (литр)
n – количество газа (моль)
m – масса (грамм)
μ – молярная масса газа (г/моль)
R – универсальная газовая постоянная R = 8,31 Дж/(моль∙) ,
где P – давление газа (Па)
V – объем (литр)
n – количество газа (моль)
m – масса (грамм)
μ – молярная масса газа (г/моль)
R – универсальная газовая постоянная R = 8,31 Дж/(моль∙)
|
 2015-04-01
2015-04-01 452
452








