A= p++n0,
где A–массовое число,
p+ или Z–число протонов и порядковый номер элемента,
n0 или N–число нейтронов.
Например: ядро атома натрия содержит 11 протонов и 12 нейтронов, массовое число – 23.
 Z = 11
Z = 11

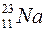 А = 23
А = 23
N = 12 (23-11)
| Изотопы – разновидности атомов одного элемента обладающие одинаковыми зарядами ядер, но разными массовыми числами. | Например: изотопы кислорода О: 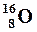 , , 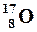 , , 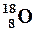 ; аргона Ar: ; аргона Ar: 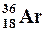 , , 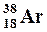 , , 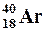 ; калия К: ; калия К: 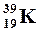 , , 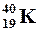 , , 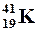 . . |
| Атомная масса элемента равна среднему значению из масс всех его природных изотопов с учетом их распространенности. | Приводится в периодической системе Менделеева. Например: природный Cl состоит из 75,4% изотопа с массовым числом М=35, а 24,6% с М=37.  а. м. = 35,453 а. м. = 35,453 |
| Ядерные реакции – превращения атомных ядер в результате их взаимодействия с элементарными частицами и друг с другом. | |
Например: 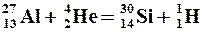 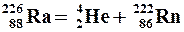 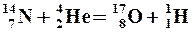 | Краткая запись: 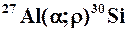 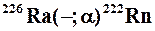 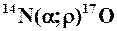 |
Обозначения: 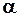 – частицы ( – частицы (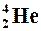 ); ); 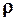 – протона ( – протона (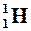 ); (–)черточка – отсутствие действующей частицы в случае радиоактивного распада. ); (–)черточка – отсутствие действующей частицы в случае радиоактивного распада. |
Элементы, состоящие только из радиоактивных изотопов называются радиоактивными: элементы с Z = 43,61,84–107.
Использование радиоактивных изотопов.
По химическим свойствам радиоактивные изотопы почти не отличаются от стабильных. Они служат в качестве «меченых» атомов. Используются в научных исследованиях в промышленности, медицине, биологии и химии.
5.2. Модель состояния электрона в атоме
 2015-04-01
2015-04-01 987
987








