ХЛОР Cl2
Общая характеристика элементов d  p p    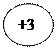 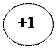 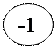 +ē s +ē s  -nē степени -nē степени 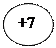 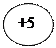  окисления окисления
F – трудносжимающийся газ Cl – легкосжимающийся газ Br – жидкость I – твердое вещество
| |||||||||||||||||||||||
| В природе:в водах океанов, морей и озер – соединения хлора. NaCl – хлорид натрия сильвинит; KCl – хлорид калия; MgCl2·6H2O – хлорид магния. | |||||||||||||||||||||||
| Получение: 1) В лаборатории: 4HCl+MnO2=Cl2+MnCl2+2H2O; 2) В промышленности: электролиз раствора NaCl(конц.), Cl2 выделяется на аноде. | |||||||||||||||||||||||
| Физические свойства:Cl2 – ядовитый газ желто-зеленного цвета с резким запахом, тяжелее воздуха в 2,5 раза. | |||||||||||||||||||||||
Химические свойства:  1) 1)
    с металлами Cu+Cl2=CuCl2; с металлами Cu+Cl2=CuCl2; 2) 3) с водородом на свету (со взрывом) Cl2+H2=2HCl; 4) вытесняет бром и йод Cl2+2KBr=2KCl+Br2; 5) с водой Cl2+H2O↔HCl+HClO – хлорноватистая кислота. Применение: обезвоживание воды и др.; отбеливание тканей и бумаги; для получение HCl, хлорной извести. |
 2015-04-01
2015-04-01 950
950



 с неметаллами 2Р+3Cl2=2РCl3;
с неметаллами 2Р+3Cl2=2РCl3;






