Основное понятие химической кинетики – скорость химической реакции.
Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени.
Математически определение средней скорости реакции Vср в интервале времени Δt записывается следующим образом:
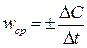 (70)
(70)
Скорость в химии – величина скалярная, является положительной, отношение же 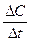 может быть как положительным, таки отрицательным, в зависимости от того, рассчитывается ли DС по исходным веществам или продуктам. Очевидно, что концентрации исходных веществ во времени уменьшаются (ΔСисх < 0), а концентрации продуктов реакции увеличиваются (ΔСпрод > 0). Поэтому при расчете по исходным веществам в уравнении (70) выбирается минус, а по продуктам – плюс.
может быть как положительным, таки отрицательным, в зависимости от того, рассчитывается ли DС по исходным веществам или продуктам. Очевидно, что концентрации исходных веществ во времени уменьшаются (ΔСисх < 0), а концентрации продуктов реакции увеличиваются (ΔСпрод > 0). Поэтому при расчете по исходным веществам в уравнении (70) выбирается минус, а по продуктам – плюс.
Истинная (или мгновенная) скорость реакции определяется как производная концентрации по времени:
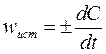 (71)
(71)
Графическое изображение зависимости концентрации реагентов от времени называется кинетической кривой (Рис. 22).
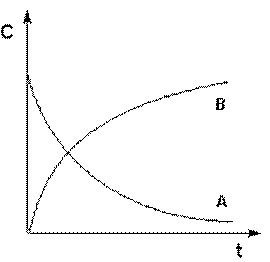
Рис. 22. Кинетические кривые для исходных веществ (А) и продуктов реакции (В).
Истинную скорость реакции можно определить графически, проведя касательную к кинетической кривой (Рис. 23); истинная скорость реакции в данный момент времени равна по абсолютной величине тангенсу угла наклона касательной (угловому коэффициенту в данной точке):
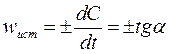
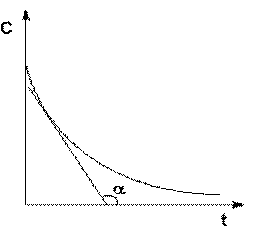
Рис. 23. Графическое определение wист.
Необходимо отметить, что в том случае, если стехиометрические коэффициенты в уравнении химической реакции неодинаковы, величина скорости реакции будет зависеть от того, изменение концентрации какого реагента определялось. Очевидно, что в реакции
2Н2 + О2 ––> 2Н2О
концентрации водорода, кислорода и воды изменяются в различной степени:
Скорость химической реакции зависит от множества факторов: природы реагирующих веществ, их концентрации, температуры, природы растворителя и т.д.
 2015-04-01
2015-04-01 557
557








