Химия изучает вещества, их свойства, проявляющиеся в химических реакциях. Поведение веществ в реакциях зависит не только от их состава, но что важнее, от строения, характера химических связей между атомами элементов, образующих вещества. Структура веществ, типы химических связей определяются электронной структурой атомов элементов. Квантовомеханическое рассмотрение возможных состояний электронов в атоме становится достаточно конкретным при использовании квантовых чисел; при этом выявляется физический смысл характеристик положения элементов в таблице периодической системы (ПС).
Главное квантовое число (n = 1,2,3… 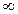 ) указывает номер энергетического уровня, определяет запас энергии электронов данного уровня, степень удаления от ядра, следовательно и размеры орбиталей; одновременно, значение n совпадает с номером периода в таблице ПС.
) указывает номер энергетического уровня, определяет запас энергии электронов данного уровня, степень удаления от ядра, следовательно и размеры орбиталей; одновременно, значение n совпадает с номером периода в таблице ПС.
Рассмотрение значений орбитального квантового числа (l = 0, 1, 2, 3 …
(n – 1), характеризует форму орбиталей) в зависимости от главного приводит к выводу, что число подуровней на уровне равно номеру энергетического уровня, равно значению n; в таблице ПС – это число электронных семейств в периоде.
|
|
|
Магнитное квантовое число ml характеризует направление орбиталей в пространстве, принимает целочисленные значения от - l до + l, включая 0. Число значений ml равно числу орбиталей на подуровне:
Nорб l = (2 l + 1)
Спиновое квантовое число ms принимает два значения (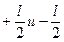 ) для каждого магнитного, что соответствует 2-х электронной емкости одной орбитали.
) для каждого магнитного, что соответствует 2-х электронной емкости одной орбитали.
Объединение выводов из значений квантовых чисел l, m l, ms приводит к формуле расчета максимально возможного числа электронов на подуровне:
Nē,max, l = 2 (2 l + 1)
Суммируя выводы из значений всех квантовых чисел, находим число орбиталей (Nорб,n) и максимально возможное число электронов на уровне
(Nе, мах, n)
Nорб,n = n
Nē, мах, n = 2n2.
Пример 1. Атомам каких элементов отвечают электронные формулы:
а) 1s22s22p63s23p63d104s24p4
б) … 3s23p63d104s24p64d45s1
Решение:
Положение элемента в таблице периодической системы характеризуется определенными значениями порядкового номера, номера периода, номера группы, типом подгруппы, принадлежностью к электронному семейству. Физический смысл названных характеристик элемента отражают электронные формулы распределения электронов в их атомах по уровням и подуровням. На современном уровне положение электронов в атоме описывают с помощью выводов из квантовой механики в виде квантовых чисел.
а) 1s22s22p63s23p63d104s24p4
↓ р-подуровень
n=4
1) Порядковый номер равен заряду ядра Z, равен числу электронов
Nē = 2 + 2 + 6 + 2 + 6 + 10 + 2 + 4 = 34.
2) Наибольшее значение главного квантового числа n = 4, что указывает на номер периода.
|
|
|
3) Идет заполнение электронами р- подуровня, следовательно элемент принадлежит к р- семейству и относится к главной подгруппе.
4) Число электронов на внешнем уровне (n = 4) равно 2 + 4 = 6; у элементов главных подгрупп эти электроны являются валентными и их число совпадает с номером группы.
Вывод: элемент имеет порядковый номер 34, относится к IV периоду, VI группе, главной подгруппе, р- семейству; все координаты элемента указывают на селен Se.
б) … 3s23p63d104s24p64d45s1
↓ n=5
d-подуровень
1) Наибольшее значение главного квантового числа n, а следовательно и номер периода равны 5.
2) Электроны заполняют d – подуровень, поэтому данный элемент относится к d – семейству, побочной подгруппе.
3) … 4d45s1→ 5 валентных электронов указывают на номер группы.
Вывод: d – элемент в V периоде, V группе - ниобий 41Nb.
Пример 2. Напишите электронные и электронно-структурные формулы валентных подуровней атомов элементов с порядковыми номерами 15 и 83. Какие значения степеней окисления характерны для этих элементов? Приведите примеры соединений. Какой из элементов образует газообразное соединение, составьте его химическую формулу и назовите.
15Р …3s23p3 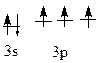
Р0 –3ē → Р+3; Р+32О3, Н3Р+3О3, Р+3Сl3
Р0 +3е → Р-3; Са3Р-32,
Фосфор – неметалл, образует газообразное соединение с водородом Р-3Н3 – фосфин. Атом фосфора в возбужденном состоянии:
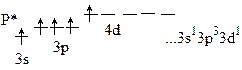
Р0 – 5ē → Р+5 Р+5Сl5, Р+52О5, НР+5 О3, Н3Р+5О4
83Bi …6s26p3 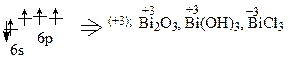
Bi* 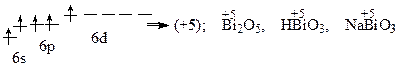
Bi – металл, газообразного соединения с водородом не образует.
 2015-04-30
2015-04-30 1047
1047
