Определение геометрической формы ионов, молекул с использованием
представлений о гибридизации атомных орбиталей
Знание геометрии молекул, ионов дает возможность характеризовать некоторые свойства веществ: полярность, устойчивость, активность.
Геометрическая форма частиц во многом зависит от типа гибридизации орбиталей центрального атома, вокруг которого координируются атомы или группы атомов других элементов. Число таких координирующихся атомов или групп атомов называется координационным числом (КЧ).
Установить тип гибридизации орбиталей центрального атома, а, следовательно, и геометрическую форму молекулы или иона можно, выполнив несколько действий в определенной последовательности:
1. Представить электронную структуру внешнего энергетического уровня, определить число валентных электронов (ē).
2. Определить степень окисления. Числовое значение степени окисления указывает на число электронов, участвующих в образовании химических связей, а также на общее количество химических связей типа s- и p-.
3. Определить координационное число (КЧ). Значение КЧ равно числу s-связей.
4. Разность между общим числом химических связей и числом s-связей есть число p-связей.
5. Разность между общим числом валентных электронов и числом электронов, участвующих в образовании связей, есть число электронов, не участвующих в образовании связей, но влияющих на тип гибридизации и геометрию молекул, ионов. ½ этой разницы дает число неподеленных электронных пар (НЭП, число двухэлектронных орбиталей.
6. Суммировать число НЭП и число s-связей. Сумма указывает на число орбиталей, участвующих в гибридизации и определяет ее тип.
7. По типу гибридизации и числу НЭП определить геометрическую форму молекулы или иона, сделать выводы о величине валентного угла, полярности.
Пример: Какую геометрическую форму имеет ион SO42-?
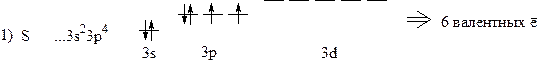
2) 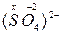 х + (-2) ×4 = -2; х = +6 ® 6ē в химических связях и 6 химических связей
х + (-2) ×4 = -2; х = +6 ® 6ē в химических связях и 6 химических связей
3) КЧ = 4 ® 4 s-связи.
4) 6 химических связей – 4 s-связи = 2p-связи.
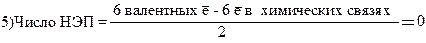
6) 0 НЭП + 4 орбитали в s-связях = 4 орбитали в гибридизации ® s+p3= (sp3)4
7) Геометрическая форма гибридных орбиталей совпадает с формой иона – тетраэдр.
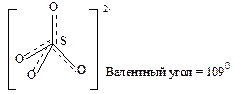
8) 2p < 4s ® p-связи делокализованы.
При определении геометрической формы молекул органических соединений необходимо учитывать особенности атома углерода:
1) валентность углерода во всех органических соединениях определяется числом внешних электронов (…2s22p2) и равна 4;
2) атомы углерода способны соединяться друг с другом, образуя цепи.
Отсюда вытекает, что в органических соединениях:
1) общее число химических связей равно 4;
2) НЭП отсутствуют;
3) при определении числа s-связей учитываются связи с соседними атомами углерода;
4) число p-связей = (4 – число s-связей);
5) число орбиталей в гибридизации равно числу s-связей;
Возможные типы гибридизации атома углерода:
s + p ®(sp)2 (линейная форма, угол между связями 1800)
s + p2 ®(sp2)3 (треугольная форма, угол между связями 1200)
s + p3 ®(sp3)4 (тетраэдрическая форма, угол между связями 1090)
Пример:
Рассмотреть структуру бензола С6Н6.
Каждый атом углерода 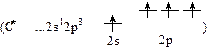 образует по 1s-связи с атомом водорода и по 2s-связи с соседними атомами углерода, всего 3s-связи; следовательно, тип гибридизации: s + p2 ® (sp2)3. Каждый фрагмент из 3-х атомов углерода и 1 атома водорода располагается на плоскости, угол между связями равен 1200. Совокупность фрагментов дает правильный шестиугольник на плоскости. Оставшиеся по одному р-электрону у каждого из шести атомов углерода образуют общую делокализованную p-связь.
образует по 1s-связи с атомом водорода и по 2s-связи с соседними атомами углерода, всего 3s-связи; следовательно, тип гибридизации: s + p2 ® (sp2)3. Каждый фрагмент из 3-х атомов углерода и 1 атома водорода располагается на плоскости, угол между связями равен 1200. Совокупность фрагментов дает правильный шестиугольник на плоскости. Оставшиеся по одному р-электрону у каждого из шести атомов углерода образуют общую делокализованную p-связь.
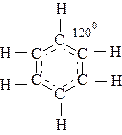
 2015-04-30
2015-04-30 1232
1232
