Составление уравнений реакций электролитов рекомендуется выполнять в определенной последовательности:
1. Составить молекулярное уравнение.
2. Определить природу исходных и образующихся веществ.
3. Переписать уравнение, изобразив каждое вещество в соответствующей форме (в виде ионов – сильные электролиты, в виде молекул – все остальные вещества).
4. Сравнить состав реагирующих и образующихся частиц, выявить одинаковые, следовательно, не принимающие участия в реакции, ионы.
5. Исключив одинаковые ионы, написать сокращенное ионно-молекулярное уравнение.
6. Сделать вывод о возможности необратимого протекания реакции. Необратимо протекают реакции в направлении наибольшего связывания ионов с образованием осадков, газов, слабых электролитов и комплексных ионов.
Если связывания ионов нет, то с точки зрения теории электролитической диссоциации реакция не происходит, но при выпаривании раствора будет получаться смесь из исходных веществ и продуктов их обмена.
Пример 1
 СаСО3 + 2СН3СООН Са(СН3СОО)2 + Н2О + СО2↑
СаСО3 + 2СН3СООН Са(СН3СОО)2 + Н2О + СО2↑
малорастворимый слабый растворимый слаб. неэлектролит
электролит электролит сильный электролит электролит
 СаСО3 + 2СН3СООН Са2+ + 2СН3СОО- + Н2О + СО2↑
СаСО3 + 2СН3СООН Са2+ + 2СН3СОО- + Н2О + СО2↑
Реакция протекает в прямом направлении, т.к. Н2О более слабый электролит, чем СН3СООН (Кдисс.Н 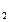 О = 1,80 · 10-16 < Кдисс. СН
О = 1,80 · 10-16 < Кдисс. СН 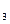 СООН = 1,85 · 10-5), а СО2 уходит из сферы реакции в виде газа.
СООН = 1,85 · 10-5), а СО2 уходит из сферы реакции в виде газа.
Пример 2
Са(NO3)2 + 2NH4Cl ↔ CaCl2 + 2NH4NO3
Растворимый растворимый растворимый растворимый
сильный сильный сильный сильный
. электролит электролит электролит электролит
Са2+ + 2NO3- + 2NH4+ + 2Cl- ↔ Са2+ + 2Cl-+ 2NH4+ + 2NO3-
Реакция не происходит, т.к. нет связывания ионов.
Для количественной оценки поведения электролитов в водных растворах в зависимости от их природы используются характеристики: степень диссоциации α, константа диссоциации Кдисс..
В водных растворах слабых электролитов устанавливается равновесие, для которого константа, называемая константой диссоциации, будет равна:
КtAn ↔ Kt+ + An-
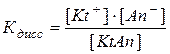
Из этого выражения следует, что Кдисс. будет иметь тем меньшее значение, чем меньше ионов в растворе, т.е. чем слабее электролит.
Константа диссоциации зависит от природы электролита, от природы растворителя, от температуры и не зависит от концентрации, поэтому является более общей характеристикой, чем степень диссоциации. Константа и степень диссоциации связаны между собой законом разбавления Оствальда:
KtAn ↔ Kt+ + An-
1 моль 1 моль 1 моль
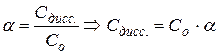
Со – молярная концентрация электролита в исходном состоянии;
Сдисс. – молярная концентрация диссоциированной части электролита.
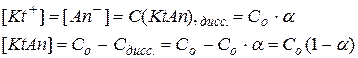
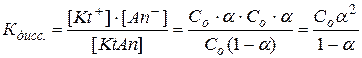
если α << 1, то 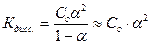 и
и 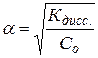
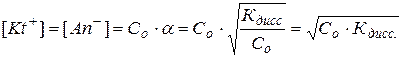
Нерастворимые и малорастворимые электролиты характеризуют произведением растворимости (ПР).
AgCl ↔ Ag+ + Cl-
Осадок р-р р-р
 В соответствии с законом действия масс, скорости прямой (υ) и обратной (υ) реакций, равны:
В соответствии с законом действия масс, скорости прямой (υ) и обратной (υ) реакций, равны:
 υ = k υ = k · [Ag+]·[Cl-]
υ = k υ = k · [Ag+]·[Cl-]
В состоянии равновесия:



 υ = υ k = k · [Ag+]·[Cl-]
υ = υ k = k · [Ag+]·[Cl-]
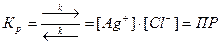
В общем виде для равновесия:
AmBn ↔ mAn+ + nBm-
ПР = [An+]m · [Bm-]n
При смешивании растворов электролитов осадок образуется, если произведение концентраций ионов превысит величину ПР.
 2015-04-30
2015-04-30 781
781








