В отличие от сильных электролитов, слабые электролиты подвергаются ЭД обратимо. В растворе слабого электролита кроме ионов всегда присутствуют недиссоциированные молекулы. Причем, если раствор не слишком сильно разбавлен, целых молекул слабого электролита в нем, как правило, значительно больше, чем ионов.
К слабым электролитам относятся:
1. Многие кислоты (они называются слабыми) и все гидроанионы:
H2CO3 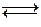 H+ + HCO
H+ + HCO 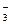 ,
,
HCO 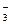
 H+ + CO
H+ + CO  ,
,
CH3COOH  CH3COO- + H+,
CH3COO- + H+,
HSO 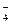
 H+ + SO
H+ + SO  .
.
2. Многие основания (они называются слабыми) и все гидроксокатионы:
Fe(OH)2  FeOH+ + OH-,
FeOH+ + OH-,
FeOH+  Fe+ + OH-,
Fe+ + OH-,
NH4OH  NH
NH 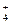 + OH-.
+ OH-.
3. Все амфотерные гидроксиды, их гидроанионы и гидроксокатионы:
Zn(OH)2  ZnOH+ + OH-,
ZnOH+ + OH-,
ZnOH+  Zn+2 + OH-,
Zn+2 + OH-,
H2ZnO2  H+ + HZnO
H+ + HZnO 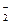 ,
,
HZnO 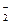
 H+ + ZnO
H+ + ZnO 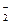 .
.
 2015-04-30
2015-04-30 475
475








