По современным представлениям, диссоциация сильного электролита является необратимым процессом (a = 1). В растворе сильного электролита нет его молекул, а есть только ионы, на которые он продиссоциировал. К сильным электролитам относятся:
1. Все соли. Соль диссоциирует как сильный электролит на кислотные остатки и основные остатки:
Fe2(SO4)3 = 2 Fe+3 + 3 SO  ,
,
NaHCO3 = Na+ + HCO 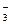 ,
,
AlOHCl2 = AlOH+2 + 2 Cl-.
2. Некоторые основания (они называются сильными основаниями или щелочами):
NaOH = Na+ + OH-,
Ba(OH)2 = Ba+2 + 2OH-.
3. Некоторые кислоты (они называются сильными кислотами):
HCl = H+ + Cl-,
HMnO4 = H+ + MnO 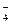 ,
,
H2SO4 = H+ + HSO 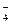 .
.
 2015-04-30
2015-04-30 541
541








