Теоретические основы. Вода - слабый электролит, диссоциирует в незначительной степени с образованием ионов водорода Н+ и гидроксил-анионов ОН  : Н2О
: Н2О 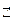 Н+ + ОН
Н+ + ОН  .
.
Состояние равновесия этой реакции характеризуется константой, которая называется ионное произведение воды:
К 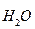 = [Н+ ]
= [Н+ ]  [ОН
[ОН  ] = 10
] = 10  14 (при 220С),
14 (при 220С),
где [Н+ ] и [ОН  ] - равновесные концентрации ионов.
] - равновесные концентрации ионов.
Обычно вместо величин [Н+] и [ОН  ] используют их отрицательные десятичные логарифмы. Эти величины называют соответственно водородным и гидроксильным показателями:
] используют их отрицательные десятичные логарифмы. Эти величины называют соответственно водородным и гидроксильным показателями:
рН = - lg [Н+ ]
рОН = - lg [ОН  ]
]
рК 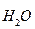 = рН + рОН = 14
= рН + рОН = 14
Нейтральные растворы не имеют избытка ионов  Н+ или ОН
Н+ или ОН  : [Н+ ] = [ОН
: [Н+ ] = [ОН  ] = 10
] = 10  7 ; рН = рОН = 7
7 ; рН = рОН = 7
Кислые растворы содержат избыток ионов Н+:
[Н+ ]> [ОН  ]; рН< рОН; рН<7; рОН>7
]; рН< рОН; рН<7; рОН>7
Щелочные растворы содержат избыток ионов ОН  :
:
[Н+ ]< [ОН  ]; рН> рОН; рН>7; рОН<7
]; рН> рОН; рН>7; рОН<7
Если растворенная в воде соль содержит ионы-остатки слабых кислот или слабых оснований, то происходит процесс гидролиза соли - обменной реакции ионов соли с молекулами воды, приводящей к образованию молекул и ионов новых слабых электролитов.
Основные правила написания реакций гидролиза:
1. Гидролизу подвергаются анионы слабых кислот и катионы слабых оснований, входящих в состав соли.
2. Гидролиз - процесс ступенчатый. На каждой ступени один гидролизующийся ион реагирует с одной молекулой воды.
3. В обычных условиях гидролиз протекает только по первой ступени. Гидролиз усиливается при нагревании и разбавлении растворов солей.
4. Гидролиз - процесс, как правило, обратимый, его равновесие можно смещать. Добавление одноименных ионов (Н+ или ОН  ), выделяющихся в процессе гидролиза, смещает равновесие в сторону уменьшения гидролиза. Добавление противоположных ионов, связывающих выделяющиеся ионы Н+ и ОН
), выделяющихся в процессе гидролиза, смещает равновесие в сторону уменьшения гидролиза. Добавление противоположных ионов, связывающих выделяющиеся ионы Н+ и ОН  в молекулы воды, смещает равновесие в сторону усиления гидролиза.
в молекулы воды, смещает равновесие в сторону усиления гидролиза.
 2015-04-30
2015-04-30 1587
1587
