1. Газдардың диффузиясы кезінде энтропияның өсуі. Қатты адиабатты қабырғалы жабық ыдыс ішінде 1 және 2 идеал газдары бар болсын. Ыдыстың жалпы көлемі өзгермейді. Бастапқы мезетте осы екі газ бір бірінен саңлаусыз қабырғамен бөлінген және бірдей 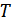 температураға ие болсын. Саңлаусыз қабырға алып тасталған соң газдар бір бірімен араласып қайтымсыз процесс жүреді. Соңында газдар бірқалыпты араласқан соң, араласу процесі тоқтап жүйе тепе тең күйге келеді. Соңғы күйдегі жүйенің температурасы бастапқыдай болады, себебі жүйе оқшауланған және газдар идеал. Осы тәжірибенің нәтижесінде жүйенің энтропиясы қалай өзгеретінін қарастырайық. Жүйені бастапқы күйден соңғы күйге өткізетін процесс үшін термодинамика анықтамасы бойынша энтропия
температураға ие болсын. Саңлаусыз қабырға алып тасталған соң газдар бір бірімен араласып қайтымсыз процесс жүреді. Соңында газдар бірқалыпты араласқан соң, араласу процесі тоқтап жүйе тепе тең күйге келеді. Соңғы күйдегі жүйенің температурасы бастапқыдай болады, себебі жүйе оқшауланған және газдар идеал. Осы тәжірибенің нәтижесінде жүйенің энтропиясы қалай өзгеретінін қарастырайық. Жүйені бастапқы күйден соңғы күйге өткізетін процесс үшін термодинамика анықтамасы бойынша энтропия 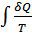 интегралын шешу арқылы анықталады. Бұл процесс қандай болса да квазистатикалық болуы шарт. Шын мәнінде бұл тәжірибедегі екі газды бөліп тұрған қабырға алып тасталғаннан кейінгі газдардың араласу процесі квазистатикалық емес. Егер біз қарастырып отырған екі газ бірдей болмаса оларды квазистатикалық араластыруға болады. Бұл процесті мынадай жолмен іске асыруға болады. Газдарды бастапқыда бөліп тұрған қабырға идеал жартылай өткізетін қабаттасқан екі a және b қабырғаларынан тұрсын (33-сурет). a қабырғасы 1 газды кедергісіз өткізіп, 2 газды өткізбейтін болсын, ал b қабырғасы 2 газды өткізіп 1 газды өткізбейтін болсын. Мұндай идеал жартылай өткізетін қабырғалар шын мәнінде жоқ. Бірақ, біз ой тәжірибесінде солай болады деп қарастыруымызға болады. Осы сипатталған a және b қабырғалары бастапқыда екі газды да өткізбейді. Адиабаттық қоршауды алып тастап жүйені температурасы
интегралын шешу арқылы анықталады. Бұл процесс қандай болса да квазистатикалық болуы шарт. Шын мәнінде бұл тәжірибедегі екі газды бөліп тұрған қабырға алып тасталғаннан кейінгі газдардың араласу процесі квазистатикалық емес. Егер біз қарастырып отырған екі газ бірдей болмаса оларды квазистатикалық араластыруға болады. Бұл процесті мынадай жолмен іске асыруға болады. Газдарды бастапқыда бөліп тұрған қабырға идеал жартылай өткізетін қабаттасқан екі a және b қабырғаларынан тұрсын (33-сурет). a қабырғасы 1 газды кедергісіз өткізіп, 2 газды өткізбейтін болсын, ал b қабырғасы 2 газды өткізіп 1 газды өткізбейтін болсын. Мұндай идеал жартылай өткізетін қабырғалар шын мәнінде жоқ. Бірақ, біз ой тәжірибесінде солай болады деп қарастыруымызға болады. Осы сипатталған a және b қабырғалары бастапқыда екі газды да өткізбейді. Адиабаттық қоршауды алып тастап жүйені температурасы 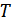 термостатпен жанастырайық. b қабырғасын ығыстыру арқылы 1-газға бастапқы
термостатпен жанастырайық. b қабырғасын ығыстыру арқылы 1-газға бастапқы 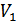 көлемнен соңғы
көлемнен соңғы 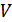 көлемге дейін квазистатикалық ұлғаюға мүмкіндік берейік. Бұл жағдайда 1-газ жұмыс атқарады. Газдың температурасы өзгермеуі үшін оны термостатпен жанастырамыз. Температура тұрақты болғандықтан энтропия өсімшесін былай анықтаймыз (§37-қара):
көлемге дейін квазистатикалық ұлғаюға мүмкіндік берейік. Бұл жағдайда 1-газ жұмыс атқарады. Газдың температурасы өзгермеуі үшін оны термостатпен жанастырамыз. Температура тұрақты болғандықтан энтропия өсімшесін былай анықтаймыз (§37-қара):
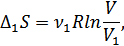
мұндағы 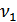 -1-газдың мольдер саны. Бұл кезде 2-газдың күйі өзгермейді. Енді тура осы жолмен 2-газ ыдыстың барлық көлемін алатындай a -қабырғасын ығыстырып 2-газды квазистатикалық ұлғайтамыз. Бұл кезде 2-газдың энтропиясының өсімшесі былай анықталады:
-1-газдың мольдер саны. Бұл кезде 2-газдың күйі өзгермейді. Енді тура осы жолмен 2-газ ыдыстың барлық көлемін алатындай a -қабырғасын ығыстырып 2-газды квазистатикалық ұлғайтамыз. Бұл кезде 2-газдың энтропиясының өсімшесі былай анықталады:
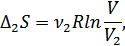
мұндағы 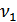 -1-газдың мольдер саны, ал
-1-газдың мольдер саны, ал 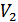 оның бастапқы көлемі. Нәтижесінде жүйе бірқалыпты араласқан тепе тең күйге келеді. Демек, нақты тәжірибе нәтижесін алдық. Жүйенің толық энтропиясының өсімшесі былай анықталады:
оның бастапқы көлемі. Нәтижесінде жүйе бірқалыпты араласқан тепе тең күйге келеді. Демек, нақты тәжірибе нәтижесін алдық. Жүйенің толық энтропиясының өсімшесі былай анықталады:
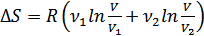 (39.1)
(39.1)
Бұл өсімше оң мәнге ие, себебі 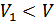 және
және 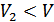 . Энтропия өсті. Адиабаталық қоршаудағы екі түрлі газ өздігінен араласуы, шынында да, қайтымсыз процесс екендігін дәлелдедік.
. Энтропия өсті. Адиабаталық қоршаудағы екі түрлі газ өздігінен араласуы, шынында да, қайтымсыз процесс екендігін дәлелдедік.
2. Гиббс парадоксі. (39.1) формуласы біртекті газдар үшін Гиббс парадоксі деп аталатын қызық қорытындыға алып келеді. Енді 1 және 2 газдар біртекті деп қарастырайық. Бұл жағдайда да (39.1) формуласына сәйкес энтропия өседі. a, b қабаттасқан жартылай өткізетін қабырғалардың екі жағындағы газдар біртекті болсын және олардың мольдер саны да бірдей болсын, демек, 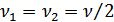 және
және 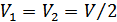 болсын, онда (39.1) формуласынан мынадай нәтиже шығады:
болсын, онда (39.1) формуласынан мынадай нәтиже шығады:
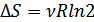 .(39.2)
.(39.2)
Бұл жағдайда да энтропия өсті, бірақ жүйенің соңғы күйі мен бастапқы күйі еш айырмасыз қалды. Осы жағдай Гиббс парадоксі деп аталады.
Гиббс парадоксін түсіну үшін (39.1) формуласы тек әртекті газдар үшін қорытылғанын ескеруіміз керек. (39.1) формуласын бірдей газдарға қолдануға болмайды. Біз қарастырған мысалдағы жартылай өткізетін қабырғалардың біртекті газдар үшін ешқандай маңызы жоқ. Себебі, бұл қабырғаның екі жағындағы газдар бірдей. 1-ші газды ғана өткізетін қабырға 2-газды да өткізеді. Сондықтан біз қарастырған әдіспен біртекті газдарды квазистатикалық араластыру мүмкін емес. Біртекті газдар үшін 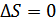 .
.
§40.Термодинамикалық потенциалдар
Термодинамикалық жүйенің күйін сипаттау үшін энтропиямен байланысты басқа да функцияларды қолдануға болады. Жүйе күйінің тәуелсіз параметрлерінің әрбір жиынтығына термодинамикалық потенциалдар сәйкес келеді.Термодинамикалық потенциалдарды қарастырғанда 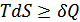 қатынасын пайдаланамыз (мұндағы теңдік белгісі –қайтымды процестер үшін, ал теңсіздік – қайтымсыз процестер үшін).
қатынасын пайдаланамыз (мұндағы теңдік белгісі –қайтымды процестер үшін, ал теңсіздік – қайтымсыз процестер үшін).
1. Энтальпия. Егер процесс квазистатикалық болса жәнетұрақты қысым кезінде өтетін болса, онда 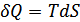 . Мұндай процесс үшін термодинамиканың бірінші бастамасы мына түрде жазылады:
. Мұндай процесс үшін термодинамиканың бірінші бастамасы мына түрде жазылады:
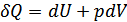 (40.1)
(40.1)
Бұл теңдеуді мына түрде қайта жазуға болады
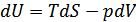 (40.2)
(40.2)
Егер жаңа күй функциясы энтальпияны 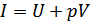 енгізетін болсақ, онда ішкі энергияны энтальпия арқылы өрнектеп мынадай өрнек аламыз:
енгізетін болсақ, онда ішкі энергияны энтальпия арқылы өрнектеп мынадай өрнек аламыз:
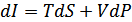 (40.3)
(40.3)
Егер 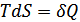 екенін ескерсек, онда тұрақты қысымда
екенін ескерсек, онда тұрақты қысымда
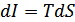 болады. Бұдан энтальпияның өсімшесі қысым тұрақты болатын квазистатикалық процестегі жүйенің алған жылу мөлшеріне тең екендігі шығады. Сондықтан энтальпияны жылулық функция деп те атайды.(40.3)-теңдеуден энтальпия
болады. Бұдан энтальпияның өсімшесі қысым тұрақты болатын квазистатикалық процестегі жүйенің алған жылу мөлшеріне тең екендігі шығады. Сондықтан энтальпияны жылулық функция деп те атайды.(40.3)-теңдеуден энтальпия 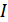 энтропия мен қысымға тәуелді функция екенін көреміз.
энтропия мен қысымға тәуелді функция екенін көреміз.
2. Ішкі энергия. Термодинамиканың бірінші бастамасы қайтымды процесс үшін: 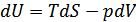 . Мұнда U- потенциалы үшін айнымалылар энтальпия S және V көлем болып табылады. Олай болса,
. Мұнда U- потенциалы үшін айнымалылар энтальпия S және V көлем болып табылады. Олай болса,
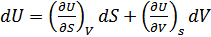 ,
,
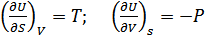 (40.4)
(40.4)
3. Еркін энергия. 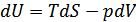 өрнегі бойынша қайтымды изотермиялық процесс кезінде атқарылатын жұмыс
өрнегі бойынша қайтымды изотермиялық процесс кезінде атқарылатын жұмыс
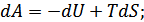
Жүйеде өтіп жатқан процесс изотермиялық екенін ескеріп былай жаза аламыз:
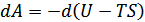 (40.5)
(40.5)
Енді еркін энергия деп аталатын тағы бір термодинамикалық функцияны енгізуге болады:
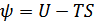 (40.6)
(40.6)
Бұл функцияны алғаш Гельмгольц енгізген болатын. Егер бұл функцияны дифференциалдасақ, онда
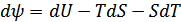
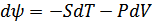 (40.7)
(40.7)
Термодинамиканың бірінші бастамасын және процестің изотермиялық екенін ескерсек, онда еркін энергия үшін мынадай өрнек аламыз:
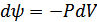 немесе
немесе 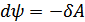 , (40.8)
, (40.8)
демек, 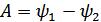 .Сонымен, еркін энергия –кемуі квазистатикалық изотермиялық процесс кезінде жүйенің атқарған жұмысына тең болатын күй функциясы. Еркін энергия Т температура мен V көлемнің функциясы болып табылады.
.Сонымен, еркін энергия –кемуі квазистатикалық изотермиялық процесс кезінде жүйенің атқарған жұмысына тең болатын күй функциясы. Еркін энергия Т температура мен V көлемнің функциясы болып табылады.
4. Гиббстің термодинамикалық потенциалы. Термодинамикада тағы бір потенциал қолданылады. Оны алғаш рет Гиббс енгізген болатын. Гиббстің термодинамикалық потенциалы:
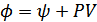 немесе
немесе 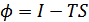
және
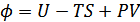 (40.9)
(40.9)
түрде жазуға болады. Егер Гиббс потенциалын дифференциалдасақ, онда
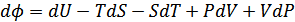
бұдан
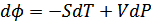 (40.10)
(40.10)
5.Зат күйінің канондық (Гиббс) теңдеулері. (40.2), (40.3), (40.7) және (40.10) қатынастарынан ішкі энергия 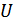 энтропия
энтропия 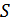 мен көлем
мен көлем 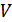 функциясы, энтальпия
функциясы, энтальпия 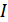 –
– 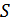 мен
мен 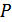 функциясы, еркін энергия
функциясы, еркін энергия 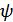 –
– 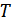 мен
мен 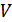 функциясы, ал термодинамикалық функция
функциясы, ал термодинамикалық функция 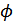 –
– 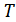 мен
мен 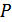 функциясы екендігін көруге болады. Демек,
функциясы екендігін көруге болады. Демек,
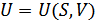 ,
, 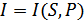 ,
, 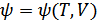 ,
, 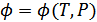 (40.11)
(40.11)
Бұл қатынастар зат күйінің канондық теңдеулері деп аталады. Бұл теңдеулерді термодинамикаға Гиббс жүйелі түрде енгізген болатын. Канондық теңдеулердің әрқайсысы зат қасиеттері туралы термиялық немесе калориялық теңдеулерге қарағанда көбірек мағлұмат беретіндігін Гиббс атап көрсеткен. (40.11) төрт теңдеудің кез келгені заттың термиялық және калориялық қасиеттері туралы толық мағлұматқа ие. (40.11) теңдеулерден мынадай қатынастар алуға болады:
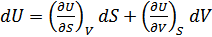 ,
, 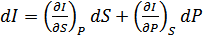 ,
,
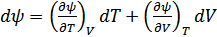 ,
, 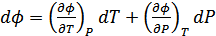 .
.
Бұлқатынастарды (40.2), (40.3), (40.7) және (40.10) қатынастарымен салыстырудан мынадай формулалар аламыз:
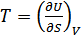 ,
, 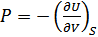 , (40.12)
, (40.12)
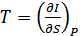 ,
, 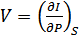 , (40.13)
, (40.13)
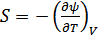 ,
, 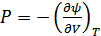 , (40.14)
, (40.14)
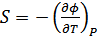 ,
, 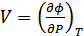 . (40.15)
. (40.15)
6. Гиббс-Гельмгольц теңдеулері. Осы алынған қатынастардан шығатын екі салдарды қарастырайық. 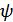 және
және 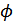 функцияларының анықтамасынан
функцияларының анықтамасынан 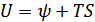 ,
, 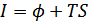 екендігі шығады. Осы қатынастарға (40.14) және (40.15) формулаларынан энтропия өрнегін қоятын болсақ, мынадай теңдеулер аламыз:
екендігі шығады. Осы қатынастарға (40.14) және (40.15) формулаларынан энтропия өрнегін қоятын болсақ, мынадай теңдеулер аламыз:
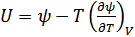 , (40.16)
, (40.16)
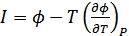 . (40.17)
. (40.17)
Осы теңдеулер Гиббс Гельмгольц теңдеулері деп аталады.
7. Максвелл қатынастары. (40.12) теңдеулерден екінші ретті дифференциал алайық:
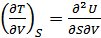 ,
, 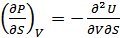 .
.
Осыдан дифференциалдаудың ретін өзгерту теоремасы негізінде былай жазуға болады:
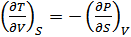 . (40.18)
. (40.18)
Осы әдіспен (40.13)–(40.15) теңдеулерінен мынадай қатынастар алуға болады:
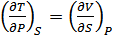 , (40.19)
, (40.19)
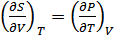 , (40.20)
, (40.20)
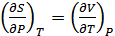 . (40.21)
. (40.21)
Осы қатынастар Максвелл қатынастары деп аталады. Бұл қатынастар жүйелердің термодинамикалық тепе тең күйлерін сипаттайтын шамалардың арасындағы қатынастарды анықтау үшін қолданылады. Бұл әдіс термодинамикалық функциялар немесе термодинамикалық потенциалдар әдісі деп аталады.
§41. Энтропияның физикалық мәні. Энтропия және ықтималдылық
1. Больцман гипотезасы. Термодинамиканың екінші бастамасы қайтымсыз процестер барысында жүйенің энтропиясы артып, жүйе тепе-тең күйге жеткенде максимал мәнге жететіндігін көрсетеді. Өз бетімен (табиғи) өтетін барлық жылулық процестер қайтымсыз процестер болып табылады. Жылулық процестердің қайтымсыздығы жүйенің тепе тең күйге өту процесінің басқа өтулерге қарағанда ықтималдығы жоғары екендігін көрсетеді. Сондықтан тәжірибелерде жүйенің ықтималдығы төмен күйден ықтималдығы жоғары күйге өтетіндігін бақылаймыз. Осыдан жүйе тепе тең күйге өткенде энтропияның және ықтималдықтың артатындығын көреміз. Демек, жүйенің қандай да бір күйіндегі энтропиясын сол күйдің ықтималдығымен байланыстыруға болады. Бұл гипотезаны алғаш Л.Больцман енгізген болатын.
Салыстырмалы үлкен флуктуациялар тек аз бөлшектерден тұратын жүйелерде орын алады. Егер тұйық жүйедегі бөлшектер саны өте көп болса, онда жүйе сипаттаушы параметрлері (мысалы, жылдамдықтары) орташа мәннен аз ауытқитын күйде көбірек болады. Бөлшектер саны көп жүйелерде салыстырмалы үлкен флуктуациялар кездеспейді дерліктей, барлық флуктуациялар аз мәндерге ие болады. Тепе-теңдік күйде оң және теріс флуктуациялар тең ықтималдықты. Егер жасанды түрде тепе-теңсіз күй жасалса, онда көбірек жағдайда жүйе ықтималдығы жоғарырақ күйге өтеді. Тұйық жүйедегі өздігінен өтетін процестер кезінде энтропия артатындығы белгілі. Сондықтан жүйенің әрбір күйіндегі энтропиясымен сол күйдің ықтималдығы арасында бірмәнді сәйкестік болуы тиіс. Енді біз осы сәйкестікті анықтайық.
2. Жүйенің ықтималдығы. Енді жүйе күйінің ықтималдығын анықтап алу керек. Мысалы, ыдыс көлемінде газ бөлшектерінің таралуын қарастыруға болады. Ыдыс ішінде 6 молекула болсын және оларды бір бірінен ажырата алу үшін әрқайсысын нөмірлейік. Егер ыдысты ойша екі бөлікке бөліп қарастырсақ, онда ыдыстың екі жағында да молекулалар болады. Молекулалардың ыдыстың екі бөлігіне тарала орналасуының 64 мүмкін әдістері бар. Молекулалардың орналасуының әрбір нұсқасына жүйенің қандай да бір күйі сәйкес келеді. Жүйенің әр күйін қанша әдіспен орындауға болатынын қарастырайық. Мысалы, ыдыстың сол жағында молекула жоқ, ал оң жағында 6 молекула болатын күйді бір ғана әдіспен іске асыруға болады. Сол жағында 1, ал оң жағында 4 молекула болатын күйді алты әдіспен, сол жағында 2, оң жағында 4 молекула болатын күйді 15 әдіспен іске асыруға болады. Ыдыстың екі жағында үш-үштен молекула болатын күйдің әдістер саны ең максимал. Сонымен, егер ыдыс ішіндегі нөмірленген  молекуланы ыдыстың екі жағына орналастыру әдістерінің саны
молекуланы ыдыстың екі жағына орналастыру әдістерінің саны 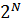 болатынына көз жеткіземіз. Осы барлық орналасулардан ыдыстың бір жағында
болатынына көз жеткіземіз. Осы барлық орналасулардан ыдыстың бір жағында 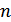 молекула, ал екінші жағында
молекула, ал екінші жағында 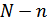 молекула болатын күйдің орналастырулар саны
молекула болатын күйдің орналастырулар саны 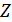 мына формуламен анықталады:
мына формуламен анықталады:
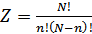 (41.1)
(41.1)
Бөлшектер саны 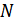 қандай болса да орналастыру әдістерінің саны
қандай болса да орналастыру әдістерінің саны 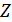 ,
, 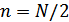 болғанда максимал мәнге ие болады. Демек, молекулалардың бірқалыпты таралуының орындалу әдістер саны ең үлкені. Ыдысты екіге емес, кез келген бөлікке бөлсек те осы нәтиже шығады.
болғанда максимал мәнге ие болады. Демек, молекулалардың бірқалыпты таралуының орындалу әдістер саны ең үлкені. Ыдысты екіге емес, кез келген бөлікке бөлсек те осы нәтиже шығады.
Ыдыстың бір жағында 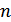 молекула, ал екінші жағында
молекула, ал екінші жағында 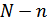 молекула болатын күйдің
молекула болатын күйдің 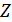 орналастырулар санын барлық мүмкін әдістер санына бөлетін болсақ, онда жүйенің сол күйінің ықтималдығын аламыз:
орналастырулар санын барлық мүмкін әдістер санына бөлетін болсақ, онда жүйенің сол күйінің ықтималдығын аламыз:
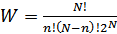 (41.2)
(41.2)
Бұл ықтималдылық та 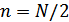 болғанда максимум мәнге ие болады.
болғанда максимум мәнге ие болады.
Жүйедегі бөлшектер саны көп болған сайын молекулалардың ыдыс ішінде бірқалыпты таралуының мүмкін әдістерінің саны басқа таралуларға қарағанда арта береді. Газ молекулаларының үздіксіз хаосты жылулық қозғалыстарының нәтижесінде жүйе әртүрлі күйлерде болуы мүмкін, бірақ жүйе күйі молекулалардың бірқалыпты таралуына сәйкес күйде болуының ықтималдылығы барлық уақытта жоғары болады.Жүйенің бұл күйі тепе тең күй болып табылады. Егер газ қандай да бір себеппен тепе теңсіздікте болса, онда сыртқы әсерлер болмаса жүйе тепе тең күйге өз бетімен келеді.
Енді осы мысалға ұқсас жағдайды қарастырып көрейік. Бізге көлемі 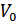 ыдыс берілсін. Осы ыдыстың ішінде
ыдыс берілсін. Осы ыдыстың ішінде 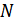 молекула болсын. Ыдысты ойша көлемдері
молекула болсын. Ыдысты ойша көлемдері 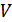 болатын бірнеше бірдей бөліктерге бөлейік. Ықтималдықтар теориясына сәйкес ыдыстағы барлық молекулалардың
болатын бірнеше бірдей бөліктерге бөлейік. Ықтималдықтар теориясына сәйкес ыдыстағы барлық молекулалардың 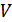 көлемінде болуының ықтималдығы былай анықталады:
көлемінде болуының ықтималдығы былай анықталады:
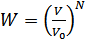 (41.3)
(41.3)
Осы мысалдардағы (41.2)және (41.3) формулалармен анықталған ықтималдықтардың мағынасы бірдей. Бірақ біз бірінші жағдайда ықтималдықты жүйенің берілген күйін іске асыру әдістерінің саны бойынша анықтасақ, екінші жағдайда математикалық әдіспен анықтап отырмыз.(41.3) формуласы ыдыстағы барлық молекулалардың 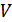 көлемінде болу ықтималдығын анықтайды.
көлемінде болу ықтималдығын анықтайды.
3. Больцман формуласы. Больцман гипотезасын іске асыру үшін 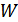 -ықтималдығы қалай анықталса да оның негізгі жалпы қасиеттерін білу қажет. Энтропия мен ықтималдық арасындағы байланыс универсал болуын талап ету керек, демек бұл байланыс
-ықтималдығы қалай анықталса да оның негізгі жалпы қасиеттерін білу қажет. Энтропия мен ықтималдық арасындағы байланыс универсал болуын талап ету керек, демек бұл байланыс 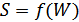 формуласымен өрнектелуі керек.
формуласымен өрнектелуі керек. 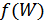 -функциясыбарлық денелер (жүйелер) үшін және олардың кез келген күйі үшін бірдей болуы керек.
-функциясыбарлық денелер (жүйелер) үшін және олардың кез келген күйі үшін бірдей болуы керек. 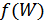 -функциясының түрін анықтау үшін күйлерінің ықтималдықтары
-функциясының түрін анықтау үшін күйлерінің ықтималдықтары 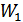 және
және 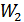 болатын екі кіші жүйелерді қарастырамыз. Олардың осы күйлердегі энтропиялары
болатын екі кіші жүйелерді қарастырамыз. Олардың осы күйлердегі энтропиялары 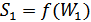 және
және 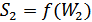 болсын. Осы екі кіші жүйені бір жүйеге біріктіріп, оның ықтималдығын
болсын. Осы екі кіші жүйені бір жүйеге біріктіріп, оның ықтималдығын 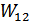 деп, ал энтропиясын
деп, ал энтропиясын 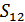 . Осы құрама жүйедегі кіші жүйелер тәуелсіз болғандықтан мына теңдік орындалады
. Осы құрама жүйедегі кіші жүйелер тәуелсіз болғандықтан мына теңдік орындалады 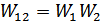 , сондықтан
, сондықтан 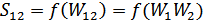 теңдігі де осы жүйе үшін орынды. Сондай-ақ күрделі жүйенің энтропиясы оның құрамындағы кіші жүйелердің энтропияларының қосындысына тең екендігі белгілі:
теңдігі де осы жүйе үшін орынды. Сондай-ақ күрделі жүйенің энтропиясы оның құрамындағы кіші жүйелердің энтропияларының қосындысына тең екендігі белгілі:
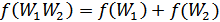 (41.4)
(41.4)
(41.4) функционалдық теңдеуін шешу үшін 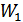 және
және 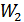 айнымалы ықтималдықтары қалай өзгерсе де олардың көбейтіндісі
айнымалы ықтималдықтары қалай өзгерсе де олардың көбейтіндісі 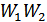 тұрақты болуын талап етеміз. Сонымен, егер
тұрақты болуын талап етеміз. Сонымен, егер 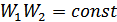 болса, онда
болса, онда
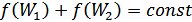 . (41.5)
. (41.5)
Осы өрнекті дифференциалдасақ
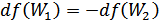 (41.6)
(41.6)
Егер
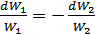 (41.7)
(41.7)
шарты орындалса, онда (41.6) теңдеуін (41.7) теңдеуіне мүшелеп бөлсек, мынадай қатынас аламыз:
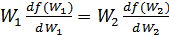 (41.8)
(41.8)
(41.8) –өрнектің сол жағында 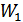 аргументіне тәуелді функция, ал оң жағында
аргументіне тәуелді функция, ал оң жағында 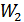 аргументіне тәуелді сол функция тұр.
аргументіне тәуелді сол функция тұр. 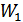 және
және 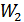 аргументтерінің мүмкін мәндері кез келген болуы мүмкін. Бұдан
аргументтерінің мүмкін мәндері кез келген болуы мүмкін. Бұдан 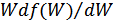 функциясы
функциясы 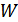 аргументі қалай өзгерсе де тұрақты болатындығы шығады.Бұл тұрақты барлық денелер үшін универсал болуы керек, себебі
аргументі қалай өзгерсе де тұрақты болатындығы шығады.Бұл тұрақты барлық денелер үшін универсал болуы керек, себебі 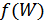 функциясы универсал екендігін білеміз. Бұл тұрақтыны
функциясы универсал екендігін білеміз. Бұл тұрақтыны 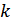 деп белгілесек, мынадай өрнек аламыз:
деп белгілесек, мынадай өрнек аламыз:
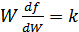 ,немесе
,немесе 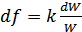
Осыдан 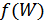 функциясы мына түрде анықталады:
функциясы мына түрде анықталады:
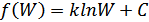
Интегралдау тұрақтысы 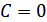 . Осы анықталған шешімді бастапқы (41.4) теңдеуіне қойсақ мынадай өрнек аламыз:
. Осы анықталған шешімді бастапқы (41.4) теңдеуіне қойсақ мынадай өрнек аламыз:
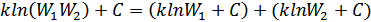
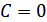 екендігін ескереміз, сонымен
екендігін ескереміз, сонымен
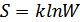 (41.9)
(41.9)
4. 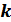 -тұрақтысын анықтау.
-тұрақтысын анықтау. 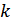 тұрақтысын анықтау үшін тәуелсіз екі әдіспен қандай да бір жүйенің энтропияларын анықтап салыстырамыз. Бір жүйенің кез келген екі күйінің энтропиялар айырымын және сол күйлердің ықтималдықтарының қатынасының логарифмін алу керек. Жүйе ретінде идеал газды қарастырамыз.
тұрақтысын анықтау үшін тәуелсіз екі әдіспен қандай да бір жүйенің энтропияларын анықтап салыстырамыз. Бір жүйенің кез келген екі күйінің энтропиялар айырымын және сол күйлердің ықтималдықтарының қатынасының логарифмін алу керек. Жүйе ретінде идеал газды қарастырамыз. 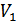 және
және 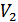 бір моль идеал газдың бастапқы және соңғы күйлердегі көлемдері болсын және бұл күйлерде газдың температурасы бірдей болсын. Ықтималдықтардың қатынасын (41.3) формуласын қолданып анықтаймыз. Ол үшін бастапқыда көлем
бір моль идеал газдың бастапқы және соңғы күйлердегі көлемдері болсын және бұл күйлерде газдың температурасы бірдей болсын. Ықтималдықтардың қатынасын (41.3) формуласын қолданып анықтаймыз. Ол үшін бастапқыда көлем 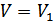 , одан кейін
, одан кейін 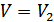 деп аламыз. Осылай екі күйдің энтропияларының айырымын мына формуламен анықтаймыз:
деп аламыз. Осылай екі күйдің энтропияларының айырымын мына формуламен анықтаймыз:
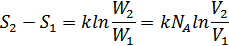
Осы шаманы 37.7 формула бойынша былай анықтаймыз:
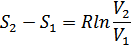
Соңғы екі өрнекті салыстырып мынадай өрнек алуға болады:
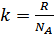 (41.10)
(41.10)
Осы анықталған іргелі тұрақты Больцман тұрақтысы болып табылады. Энтропия мен ықтималдықты байланыстыратын (41.9) іргелі қатынасын Больцман алғаш анықтаған және Больцман формуласы деп аталады. Ал осы формуланы келтірілген қорыту әдісін Планк алғаш қолданған. Сондай-ақ 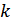 тұрақтысын да Планк енгізген болатын.
тұрақтысын да Планк енгізген болатын.
 2015-04-30
2015-04-30 1754
1754
