1. Ішкі энергия анықтамасы. Ішкі энергия термодинамикалық тепе-теңдіктегі жүйені сипаттайтын маңызды шамалардың бірі болып табылады. Сондықтан біз термодинамикалық жүйені қарастырғанда оның бастапқы және соңғы күйлері орнықты тепе-теңдікте болады деп ескереміз. Алайда жүйені бір күйден екінші күйге өткізетін процестер және аралық күйлер орнықсыз болуы мүмкін.
Жүйенің ішкі энергиясы – өсімшесі адиабаталық қоршаудағы жүйенің жасайтын кез келген процестерінде жүйе бастапқы тепе-тең күйден соңғы тепе-тең күйге өтуі үшін жүйе үстінен жасалатын сыртқы күштердің жұмысына тең болатын күй функциясы болып табылады. Мұндай күй функциясын енгізу адиабаталық қоршаудағы жүйе үстінен жасалатын жұмыс тек қана жүйенің бастапқы және соңғы күйлеріне ғана тәуелді болатынымен және бастапқы күйден соңғы күйге өту әдісінен тәуелді емсе екендігімен байланыстырылады. Бастапқы күйді 1 индексімен ал соңғы күйді 2 индексімен белгілейік. Сонымен, адиабаталық қоршаудағы жүйе үшін:
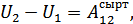 (22.1)
(22.1)
мұндағы 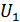 және
және 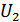 жүйенің 1, 2 -ші күйлеріндегі ішкі энергиялары, ал
жүйенің 1, 2 -ші күйлеріндегі ішкі энергиялары, ал 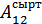 - жүйе 1 -күйден 2 -күйге кез келген жолмен өткендегі сыртқы күштердің жұмысы.
- жүйе 1 -күйден 2 -күйге кез келген жолмен өткендегі сыртқы күштердің жұмысы.
2.Нөлдік күйді таңдау. Ішкі энергия бір мәнді анықталмаған, қандай-да бір аддитивті тұрақты дәлдігіне дейін анықталған. Энергияның өзі нақты мағынаға ие емес, ал олардың әр түрлі күйлердегі мәндерінің айырымы аддитивті тұрақтыны таңдауға тәуелсіз және нақты мағынаға ие. Қандай да бір күйді нөлдік күй ретінде таңдауға келісуге болады, бұл күйде ішкі энергия мәні нөлге тең болады. Сонда басқа күйлердің ішкі энергияларының мәндері бірмәнді анықталады. Осыларды ескеріп ішкі энергияның анықтамасын былай тұжырымдаймыз: Қандайда бір тепе-теңдік күйдегіжүйенің ішкі энергиясы кез келген мүмкін адиабаталық жолмен жүйені нөлдік күйден қарастырылатын күйге өткізу үшін жүйе үстінен жасалатын сыртқы күштердің жұмысына тең болады.
Егер бұл бағытта адиабаталық процесс мүмкін болмаса, онда кері процесті қарастыруға болады, демек жүйенің нөлдік күйден қарастырылатын күйге өту процесін қарастырамыз. Бұл жағдайда сыртқы күштердің жұмысын теріс таңбамен алу керек.Осыны ескеріп ішкі энергия анықтамасын былай тұжырымдаймыз: Қандайда бір тепе-теңдік күйдегіжүйенің ішкі энергиясы кез келген мүмкін адиабаталық жолмен жүйені қарастырылатын күйден нөлдік күйге өткізу үшін жүйе үстінен жасалатын сыртқы күштердің теріс таңбамен алынған жұмысына тең болады.
3. Квазистатикалық процестер үшін 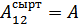 , мұндағы
, мұндағы 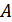 жүйенің атқаратын жұмысы. Осыны ескеріп (1) өрнекті былай жазуға болады:
жүйенің атқаратын жұмысы. Осыны ескеріп (1) өрнекті былай жазуға болады:
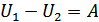
Демек, адиабаталық процестер кезінде жүйенің жұмысы ішкі энергияның кемуі есебінен атқарылады.
4. Адиабаталық қоршаудағы жүйе үшін термодинамиканың бірінші бастамасы. Адиабаталық қоршау деп ішіндегі дене сыртқы ортадан жылу алмайтын және сыртқа жылуды шығармайтын қоршауды айтамыз. Мұндай қоршаудың, жалпы жағдайда, кейбір бөліктері қозғалмалы болуы мүмкін. Оның мысалы ретінде жылу өткізбейтін жылжымалы поршенмен жабылған, ішінде газы бар цилиндрді қарастыруға болады. Осындай қоршау ішіндегі жүйенің күйін әртүрлі әдістермен өзгертуге болады. Жүйе күйін өзгерту әдісі ретінде қоршаудың жылжымалы бөлігін сыртқы күштер әсерімен орын ауыстыруды қарастырамыз. Бұл кезде сыртқы күш әсерінен цилиндр ішіндегі газдың көлемі өзгереді, демек сыртқы күш жұмыс атқарады. Жүйе күйінің өзгеру процесі адиабаталық қоршауда өтетіндіктен жүйе сырттан ешқандай жылу алмайды және сыртқы ортаға жылу бермейді, демек 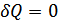 . Олай болса, термодинамиканың бірінші бастамасын адиабаталық қоршаудағы жүйе үшін былай жазуға болады:
. Олай болса, термодинамиканың бірінші бастамасын адиабаталық қоршаудағы жүйе үшін былай жазуға болады:
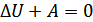 (22.2)
(22.2)
немесе
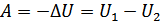 .
.
Бақылау сұрақтары:
1. Ішкі энергияның анықтамасын тұжырымда.
2. Жүйенің ішкі энергиясының өзгерісіоның бір күйден екінші күйге өту жолына тәуелді ме?
3. Адиабаталық қоршаудағы жүйенің ішкі энергиясының өзгерісі қалай анықталады?
§23. Жылу мөлшері
1.Жылу мөлшері, жылу алмасу. Егер жүйе адиабаттық қоршауда болса, онда жүйенің ішкі энергиясын оның үстінен макроскопиялық жұмыс атқару арқылы ғана өзгертуге болады. Алайда, жүйе адиабаттық қоршауда болмаса, онда оның ішкі энергиясын әртүрлі жолдармен макроскопиялық жұмыс атқармай-ақ өзгертуге болады. Мысалы, ыстық дене мен суық денені бір-бірімен жанастырғанда макроскопиялық жұмыс атқарылмаса да ішкі энергия ыстық денеден суық денеге өтеді.
Бір-бірімен жанастырылған денелердің макроскопиялық жұмыс атқармай өтетін ішкі энергиямен алмасу процесі жылу алмасу деп аталады. Жылу алмасу процесі нәтижесінде сыртқы ортаның денеге берген энергиясы дененің алған жылу мөлшері немесе жылу деп аталады.
2.Жылу мөлшері күй функциясы емес. Дененің алған жылу мөлшері күй функциясы емес. Мұны термодинамиканың бірінші бастамасынан-ақ көруге болады. Шынында да 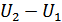 айырымы тек қана жүйенің бастапқы және соңғы күйлеріне тәуелді, ал
айырымы тек қана жүйенің бастапқы және соңғы күйлеріне тәуелді, ал 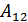 жұмыс бір күйден екінші күйге өту жолына да тәуелді. Сондықтан
жұмыс бір күйден екінші күйге өту жолына да тәуелді. Сондықтан 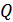 жылу мөлшері осы өту жолына, демек жүйе қарастырылып отырған күйге қандай әдіспен келгеніне тәуелді. Бұдан жылу мөлшері де күй функциясы емес деген қорытынды жасауға болады. Жүйені қарастырылатын күйге көптеген әдістермен, жолдармен өткізуге болады. Осы барлық әдістерде жүйеге бірдей ішкі энергия беріледі, бірақ осы берілген энергия шамасын жұмыс пен денеге берілген жылу мөлшеріне бөлу әр жағдайда әртүрлі болады. Егер жүйенің орныққан күйі белгілі болса, ал осы күйге жүйенің қандай әдіспен (жолмен) келгені белгісіз болса, онда жүйенің алған жылу мөлшері туралы ештеңе айту мүмкін емес. Бірақ барлық уақытта жүйенің ішкі энергиясы туралы айтуға болады, себебі ол жүйенің сол күйге қалай келгеніне тәуелді емес. Ал, жүйенің алған жылу мөлшері туралы тек процесс түрі көрсетілгенде ғана айтуға болады.
жылу мөлшері осы өту жолына, демек жүйе қарастырылып отырған күйге қандай әдіспен келгеніне тәуелді. Бұдан жылу мөлшері де күй функциясы емес деген қорытынды жасауға болады. Жүйені қарастырылатын күйге көптеген әдістермен, жолдармен өткізуге болады. Осы барлық әдістерде жүйеге бірдей ішкі энергия беріледі, бірақ осы берілген энергия шамасын жұмыс пен денеге берілген жылу мөлшеріне бөлу әр жағдайда әртүрлі болады. Егер жүйенің орныққан күйі белгілі болса, ал осы күйге жүйенің қандай әдіспен (жолмен) келгені белгісіз болса, онда жүйенің алған жылу мөлшері туралы ештеңе айту мүмкін емес. Бірақ барлық уақытта жүйенің ішкі энергиясы туралы айтуға болады, себебі ол жүйенің сол күйге қалай келгеніне тәуелді емес. Ал, жүйенің алған жылу мөлшері туралы тек процесс түрі көрсетілгенде ғана айтуға болады.
3.Жылу резервуары. Жылулық энергия термині өте көп таралған. Бірақ бұл ұғымды жылу мөлшері мағынасында қолдануға болмайды. Жылулық энергия түсінігін дененің ішкі энергиясы деп түсінген дұрыс. Жылулық (ішкі) энергиясының қоры бар денелер жылу резервуары деп аталады. Жылу резервуарында жылу қоры бар деп те айтылады. Мұнда да жылу қоры дегенді ішкі энергия қоры деп түсінген дұрыс.
4. Энтальпия – жылу функциясы. Енді тұрақты көлем немесе тұрақты қысым кезінде жүйеде өтетін құбылыстарды қарастырайық. Егер көлем тұрақты болса, онда 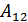 жұмысы нөлге тең болады, онда термодинамиканың бірінші бастамасы мына түрге келеді:
жұмысы нөлге тең болады, онда термодинамиканың бірінші бастамасы мына түрге келеді:
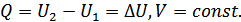 (23.1)
(23.1)
Егер қысым тұрақты болса, онда 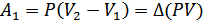 . Бұл жағдайда термодинамиканың бірінші бастамасын мына түрде жаза аламыз:
. Бұл жағдайда термодинамиканың бірінші бастамасын мына түрде жаза аламыз:
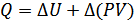
немесе дифференциалдық түрде былай жазамыз:
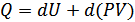
Енді жаңа шама енгіземіз:
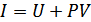 (23.2)
(23.2)
Бұл шама күй функциясы болып табылады, себебі оны анықтайтын
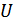 ,
, 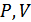 шамалары да күй функциялары. Жаңа функцияны ескерсек, изобаралық процесс үшін жүйенің алған жылу мөлшерін былай көрсетуге болады:
шамалары да күй функциялары. Жаңа функцияны ескерсек, изобаралық процесс үшін жүйенің алған жылу мөлшерін былай көрсетуге болады:
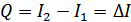 ,
, 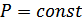 (23.3)
(23.3)
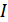 функциясының термодинамикадағы орыны маңызды. Оны энтальпия немесе жылулық функция деп атайды. Энтальпия изобаралық процесте өсімшесі жүйенің алған жылу мөлшеріне тең күй функциясы болып табылады.
функциясының термодинамикадағы орыны маңызды. Оны энтальпия немесе жылулық функция деп атайды. Энтальпия изобаралық процесте өсімшесі жүйенің алған жылу мөлшеріне тең күй функциясы болып табылады.
Сонымен, егер жүйенің көлемі тұрақты болса, онда жүйенің алған жылу мөлшері ішкі энергияның өсімшесіне, ал қысымы тұрақты болғанда – энтальпияның өсімшесіне тең болады екен.
5. Гесс заңы. Термохимияда реакцияның жылулық тиімділігі деп сол реакция кезінде бөлінген жылу мөлшерін айтады. Егер реакция нәтижесінде қандай да бір жаңа қосылыс түзілсе, онда жылулық тиімділік түзілу жылуы деп те атайды. Егер реакция кезінде жылу бөлінетін болса мұндай реакция экзотермиялық деп аталады, ал жылу жұтылса – эндотермиялық деп аталады. Бірінші жағдайда жылулық тиімділік оң деп есептеледі, ал екіншіде – теріс. Егер жылулық тиімділікті 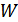 әрпімен белгілесек, онда
әрпімен белгілесек, онда 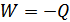 болады. Егер реакция тұрақты көлемде өтсе:
болады. Егер реакция тұрақты көлемде өтсе:
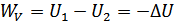 (23.4)
(23.4)
Сәйкесінше, реакция тұрақты қысымда өтсе, онда
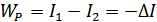 (23.5)
(23.5)
(23.4) және (23.5) өрнектер реакцияның жылулық тиімділігі тек қана бастапқы заттардың табиғатына және физикалық күйіне тәуелді екені, ал реакцияның аралық сатыларына тәуелсіз екендігін көрсетеді. Бұл заңды 1840 жылы орыс академигі Гесс (1802-1850) термодинамиканың бірінші бастамасынан бұрын ашқан болатын.
Бақылау сұрақтары:
1. Қандай процесті жылу алмасу процесі деп атайды?
2. Жылу алмасу процесі кезінде бір денеден екінші денеге өтетін энергияны қалай атайды?
3. Жылу мөлшері күй функциясы ма?
4. Қандай денелер жылу резервуары деп аталады?
5. Энтальпия қалай анықталады?
6. Гесс заңын түсіндіріңіз.
§24. Жылусыйымдылық
1.Меншікті, мольдік жылусыйымдылық. Дененің 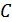 жылусыйымдылығы деп дененің алған шексіз аз
жылусыйымдылығы деп дененің алған шексіз аз 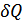 жылу мөлшерінің сол дененің температурасының
жылу мөлшерінің сол дененің температурасының 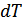 өсімшесіне қатынасын айтамыз:
өсімшесіне қатынасын айтамыз:
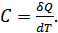 (24.1)
(24.1)
Егер заттың бірлік массасы қарастырылатын болса, онда меншікті жылусыйымдылық анықтамасы былай тұжырымдалады. Заттың бірлік массасының температурасын 1 градусқа өзгертуге қажетті жылу мөлшерін сол заттың меншікті жылусыйымдылығы деп атаймыз:
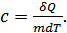 (24.2)
(24.2)
Термодинамикада көбіне мольдік жылусыйымдылығы қолданылады. Заттың бір молінің температурасын 1 градусқа өзгертуге қажетті жылу мөлшерін сол заттың мольдік жылусыйымдылығы деп атаймыз:
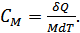 (24.3)
(24.3)
2.Көлем және қысым тұрақты болғандағы жылусыйымдылықтар. Егер термодинамиканың бірінші бастамасына (24.1) теңдеуді қойсақ, ондажылусыйымдылық үшін:
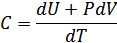
ал,
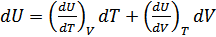 ,
,
болғандықтан,
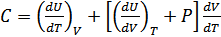 (24.4)
(24.4)
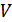 көлем тек
көлем тек 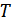 температураға ғана емес, сондай-ақ
температураға ғана емес, сондай-ақ 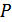 қысымға да тәуелді.Қысымның қалай өзгергеніне байланысты
қысымға да тәуелді.Қысымның қалай өзгергеніне байланысты 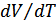 кез келген мәнді қабылдауы мүмкін. (24.4) өрнектің мағынасы бірмәнді болуы үшін бұл қатынастың мәнін тұрақтандыру керек. Бірақ жылусыйымдылықтың мәні
кез келген мәнді қабылдауы мүмкін. (24.4) өрнектің мағынасы бірмәнді болуы үшін бұл қатынастың мәнін тұрақтандыру керек. Бірақ жылусыйымдылықтың мәні 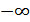 ÷
÷ 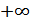 аралығында кез келген мәнді қабылдауы мүмкін. Мысалы, изотермиялық процесс үшін сыйымдылықтың мәні
аралығында кез келген мәнді қабылдауы мүмкін. Мысалы, изотермиялық процесс үшін сыйымдылықтың мәні 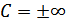 болады, себебі
болады, себебі 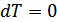 ,
, 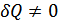 . Адиабаттық процесс үшін
. Адиабаттық процесс үшін 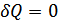 ,
, 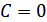 .
.
Сәйкесінше, 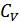 және
және 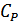 деп белгіленетін көлем және қысым тұрақты болғандағы жылусыйымдылықтар ерекше маңызды. Егер көлем тұрақты болса, онда
деп белгіленетін көлем және қысым тұрақты болғандағы жылусыйымдылықтар ерекше маңызды. Егер көлем тұрақты болса, онда 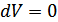 , бұдан
, бұдан
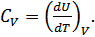 (24.5)
(24.5)
Егер қысым тұрақты болса, онда 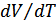 қатынасы
қатынасы 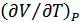 дербес туындысына айналады. Бұл жағдайда (24.4) формула мынадай нәтижеге алып келеді:
дербес туындысына айналады. Бұл жағдайда (24.4) формула мынадай нәтижеге алып келеді:
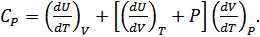 (24.6)
(24.6)
Жылусыйымдылықтардың 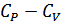 айырымы үшін мынадай өрнек аламыз:
айырымы үшін мынадай өрнек аламыз:
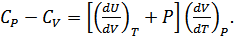 (24.7)
(24.7)
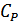 жылусыйымдылығы үшін өрнек алуға болады. Егер процесс тұрақты қысымда өтетін болса, онда энтальпияның анықтамасы бойынша
жылусыйымдылығы үшін өрнек алуға болады. Егер процесс тұрақты қысымда өтетін болса, онда энтальпияның анықтамасы бойынша 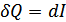 . Сондықтан
. Сондықтан
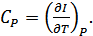 (24.8)
(24.8)
Бақылау сұрақтары:
1. Қандай физикалық шаманы жылусиымдылық деп атаймыз?
2. Меншікті жылу сиымдылығы қалай анықталады?
3. Тұрақты көлем кезіндегі жылусиымдылық қалай анықталады?
4. Тұрақты қысым кезіндегі жылусиымдылық қалай анықталады?
§25. Идеал газдың ішкі энергиясы. Джоуль заңы
1.Калориметриялық күй теңдеуі. Жалпы термодинамикалық қатынас-тардан нақты нәтижелер алу үшін біріншіден күй теңдеуін
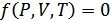 (25.1)
(25.1)
екіншіден, дененің күйін анықтайтын параметрлердің функциясы ретінде ішкі энергияны білу қажет, мысалы
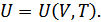 (25.2)
(25.2)
(25.2) өрнек түріндегі тәуелділік калориметриялық күй теңдеуі деп аталады, ал (25.1) өрнек түріндегі тәуелділік бізге белгілі – термиялық күй теңдеуі. Бұл екі тәуелділік тәжірибеде ғана анықталады.
2.Гей-Люссакжәне Джоуль тәжірибелері. Термодинамиканың бірінші бастамасының идеал газға қолдануын қарастырайық. Идеал газдардың термиялық күй теңдеуі – Менделеев-Клапейрон теңдеуі болып табылады. Бір моль идеал газ үшін бұл теңдеу мына түрде жазылады:
| А |
| В |
| С |
| 20-сурет |
3.Джоуль-Томсон құбылысы. Гей-Люссак пен Джоулдің тәжірибелерінің дәлдігі өте төмен болды. Себебі ауаның жылусыйымдылығы ыдыстар мен калориметрдегі судың жылусыйымдылықтарымен салыстырғанда аз болды. 1852-1862 жылдары Джоуль мен Томсон бірге жасаған тәжірибелері үлкен дәлдікпен орындалды. Бұл тәжірибелердің нәтижесінде тек қана ішкі энергияның көлемге тәуелділігі зерттеліп қоймай, сонымен қатар Джоуль-Томсон құбылысы деп аталатын маңызды физикалық құбылыс ашылды.
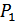 |
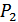 |
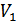 |
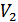 |
| B |
| A |
| B/ |
| M |
| A/ |
| N |
| M/ |
| N/ |
| 21-сурет. |
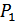 және
және 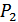 қысымдары үнемі тұрақты болуы қамтамасыз етілді. Тығын мен газ процесс кезінде бір-бірімен жылу алмасады. Ал, процесс стационар болғанда жылу алмасу тоқтап, тығынның физикалық күйі, демек ішкі энергиясы тұрақты болады. Стационар ағыс кезінде тығынның бір жағында
қысымдары үнемі тұрақты болуы қамтамасыз етілді. Тығын мен газ процесс кезінде бір-бірімен жылу алмасады. Ал, процесс стационар болғанда жылу алмасу тоқтап, тығынның физикалық күйі, демек ішкі энергиясы тұрақты болады. Стационар ағыс кезінде тығынның бір жағында 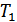 , ал екінші жағында
, ал екінші жағында 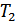 температуралары орнығады. Осы температуралар тәжірибе кезінде өлшенген. Газдың тығын арқылы стационар ағысы Джоуль-Томсон процесі деп аталады, ал осындай ағыс кезінде температураның өзгеруі Джоуль-Томсон құбылысы деп аталады. Ағыс өте баяу болғанымен бұл процесс квазистатикалық емес, себебі жалпы жүйеде термодинамикалық тепе-теңдік жоқ.
температуралары орнығады. Осы температуралар тәжірибе кезінде өлшенген. Газдың тығын арқылы стационар ағысы Джоуль-Томсон процесі деп аталады, ал осындай ағыс кезінде температураның өзгеруі Джоуль-Томсон құбылысы деп аталады. Ағыс өте баяу болғанымен бұл процесс квазистатикалық емес, себебі жалпы жүйеде термодинамикалық тепе-теңдік жоқ. 4. Тығынның сол жағында ойша ABNM кеңістігін алып тұрған газдың 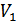 көлемін қарастырайық (21-сурет). Тығыннан өткен соң бұл газ оң жақтағы M/N/B/A/ кеңістіктегі
көлемін қарастырайық (21-сурет). Тығыннан өткен соң бұл газ оң жақтағы M/N/B/A/ кеңістіктегі 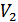 көлемді алады. Осы процеске термодинамиканың бірінші бастамасын қолданайық. AB шекарасы MN шекарасына жетеді. Бұл кезде газ үстінен
көлемді алады. Осы процеске термодинамиканың бірінші бастамасын қолданайық. AB шекарасы MN шекарасына жетеді. Бұл кезде газ үстінен 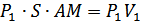 (S -цилиндрдің көлденең қимасының ауданы) жұмысы атқарылады. M/N/ шекарасы A/B/ орынына барады, газ
(S -цилиндрдің көлденең қимасының ауданы) жұмысы атқарылады. M/N/ шекарасы A/B/ орынына барады, газ 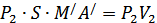 жұмысын атқарады. Газдың атқарған толық жұмысы
жұмысын атқарады. Газдың атқарған толық жұмысы 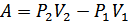 . Газ сырттан жылу алған жоқ, себебі цилиндр адиабаталық оқшауланған. Тығынның физикалық күйі, ішкі энергиясы өзгеріссіз қалған. Сондықтан термодинамиканың бірінші бастамасын осы процесс үшін былай жазамыз:
. Газ сырттан жылу алған жоқ, себебі цилиндр адиабаталық оқшауланған. Тығынның физикалық күйі, ішкі энергиясы өзгеріссіз қалған. Сондықтан термодинамиканың бірінші бастамасын осы процесс үшін былай жазамыз:
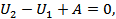
немесе
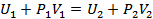 .(25.3)
.(25.3)
Энтальпияның анықтамасы бойынша 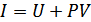 . Сондықтан (25.3) теңдік Джоуль-Томсон процесінде газдың энтальпиясы өзгермейтінін көрсетеді:
. Сондықтан (25.3) теңдік Джоуль-Томсон процесінде газдың энтальпиясы өзгермейтінін көрсетеді:
 . (25.4)
. (25.4)
5.Техникалық Джоуль-Томсон құбылысын тығынды қолданбай іске асыруға болады. Жоғары қысымда тұрған газды қысымы төмен кеңістікке вентиль немесе жіңішке саңлау арқылы ағуға мәжбүрлейді. Мұндай процесс газдың дроссельденуі деп аталады.Бұл процесс кезінде де энтальпия тұрақты болып қалады.
6. Джоуль заңы. Джоуль-Томсон тәжірибесінің нәтижелерін идеал газдың ішкі энергиясының көлемге тәуелділігін анықтауға қолданайық. Джоуль-Томсон тәжірибесінде газдың стационар ағыны кезінде тығынның екі жағындағы температурасы өлшенген. Тәжірибе нәтижесінде барлық газдың температуралары төмендеді, ал сутегі үшін температура аздап артқан. Температуралардың 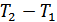 айырмасы газ үшін Менделеев-Клапейрон теңдеуі дәлірек орындалғанда азаяды, демек газ идеал газ заңдарына дәлірек бағынған сайыназаяды. Бұдан, идеал газдар үшін
айырмасы газ үшін Менделеев-Клапейрон теңдеуі дәлірек орындалғанда азаяды, демек газ идеал газ заңдарына дәлірек бағынған сайыназаяды. Бұдан, идеал газдар үшін 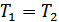 болады деп ескереміз. Бойль-Мариотт заңына сәйкес
болады деп ескереміз. Бойль-Мариотт заңына сәйкес 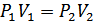 ,
,
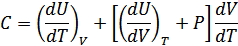
теңдеуі 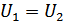 екендігін көрсетеді, басқаша жазсақ:
екендігін көрсетеді, басқаша жазсақ:
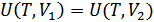 (25.5)
(25.5)
Сонымен, идеал газдың ішкі энергиясы тұрақты температура кезінде көлемге тәуелді емес. Басқаша айтқанда, идеал газ үшін ішкі энергия 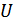 тек қана температураның
тек қана температураның 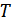 функциясы болып табылады. Бұл тәжірибелік факт Джоуль заңы деп аталады.
функциясы болып табылады. Бұл тәжірибелік факт Джоуль заңы деп аталады.
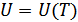 (25.6)
(25.6)
7.Роберт Майер теңдеуі. (24.7) теңдеуді идеал газ үшін қолданып көрейік. Джоуль заңы бойынша 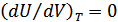 , Менделеев-Клапейрон теңдеуінен -
, Менделеев-Клапейрон теңдеуінен - 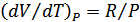 . Сондықтан, (23.7) теңдеуінен
. Сондықтан, (23.7) теңдеуінен
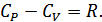 (25.7)
(25.7)
Осы маңызды қатынас Роберт Майер теңдеуі деп аталады.
25.7 теңдеуді шығарудың тағы бір жолын қарастырайық. Поршенді цилиндрде идеал газдың бір молі болсын. Поршенді бекітіп қойып газ температурасын 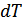 -ға арттырайық. Газ көлемі тұрақты болғандықтан мұндай қыздыруға қажетті жылу мөлшері
-ға арттырайық. Газ көлемі тұрақты болғандықтан мұндай қыздыруға қажетті жылу мөлшері 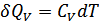 . Бұл кезде жұмыс атқарылмайтын болғандықтан бұл жылу мөлшері ішкі энергияның өсімшесіне тең болады:
. Бұл кезде жұмыс атқарылмайтын болғандықтан бұл жылу мөлшері ішкі энергияның өсімшесіне тең болады:
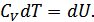 (25.8)
(25.8)
Енді осы газбен басқа тәжірибе жасайық. Газдың бастапқы күйі бірінші жағдайдағыдай (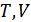 ) болсын. Бірақ поршенді бос жібереміз, демек оған тұрақты сыртқы
) болсын. Бірақ поршенді бос жібереміз, демек оған тұрақты сыртқы 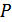 қысым әсер етеді.
қысым әсер етеді. 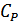 жылусыйымдылығының анықтамасы бойынша газ температурасын
жылусыйымдылығының анықтамасы бойынша газ температурасын 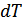 -ға арттыру үшін
-ға арттыру үшін 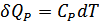 жылу мөлшері қажет. Бұл кезде
жылу мөлшері қажет. Бұл кезде 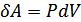 жұмысы атқарылады. Қысым тұрақты болғандықтан бұл жұмысты мына түрде жаза аламыз
жұмысы атқарылады. Қысым тұрақты болғандықтан бұл жұмысты мына түрде жаза аламыз 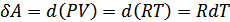 . Газдың ішкі энергиясы тек қана температураға тәуелді болғандықтан, оның шамасы бірінші жағдайдағыдай мәнге өзгереді. Сондықтан екінші тәжірибеде
. Газдың ішкі энергиясы тек қана температураға тәуелді болғандықтан, оның шамасы бірінші жағдайдағыдай мәнге өзгереді. Сондықтан екінші тәжірибеде
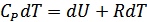
немесе
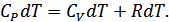 (25.9)
(25.9)
Осы теңдеудің екі жағын да 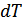 -ға бөліп Роберт Майер теңдеуін аламыз:
-ға бөліп Роберт Майер теңдеуін аламыз:
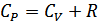 .
.
Бақылау сұрақтары:
1. Калориметриялық күй теңдеуі қандай параметрлерге тәуелді?
2. Гей-Люссак және Джоуль тәжірибелері қандай қорытындыға алып келді?
3. Джоуль-Томсон құбылысы қалай орындалады?
4. Техникалық Джоуль-Томсон құбылысын сипаттаңыз.
5. Идеал газдың ішкі энергиясы тұрақты температура кезінде көлемге тәуелді ме?
6. Идеал газ үшін ішкі энергия 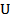 тек қандайпараметрдің функциясы?
тек қандайпараметрдің функциясы?
7. Роберт Майер теңдеуін жазып көрсет.
§26. Адиабаттық процесс. Пуассон теңдеуі
1. Пуассон теңдеуі. Егер жүйеге жылу берілмесе және жүйеден жылу алынбаса, онда мұндай процесс адиабаталық процесс болып табылады. Газ квазистатикалық адиабатты процесс жасағанда идеал газдың күйін сипаттайтын параметрлер бір-бірімен қалай байланысатынын анықтайық. Адиабаттық процесс үшін 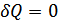 , ал
, ал 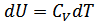 , онда
, онда
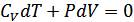 (26.1)
(26.1)
Менделеев-Клапейрон теңдеуінен
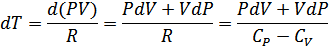
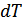 -ны (26.1) теңдеуге қойып мынадай өрнек аламыз:
-ны (26.1) теңдеуге қойып мынадай өрнек аламыз:
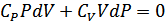
Жаңа белгілеу енгізейік
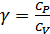 (26.2)
(26.2)
Онда
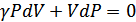 (26.3)
(26.3)
| P |
| V |
| 1 |
| V2 |
| V1 |
| 0 |
| 22-сурет. |
| 2 |
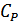 және
және 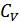 жылусыйымдылықтары температураға тәуелді болуы мүмкін. Бірақ, көбінесе газдардың жылусыйымдылықтары температураның кең интервалында тұрақты болады, демек олардың қатынасы
жылусыйымдылықтары температураға тәуелді болуы мүмкін. Бірақ, көбінесе газдардың жылусыйымдылықтары температураның кең интервалында тұрақты болады, демек олардың қатынасы 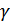 да тұрақты. (26.3) теңдеуі оңай интегралданады және мынадай өрнек алынады:
да тұрақты. (26.3) теңдеуі оңай интегралданады және мынадай өрнек алынады: 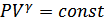 (26.4)
(26.4)
Бұл өрнек Пуассон (1781-1840) теңдеуі деп аталады. Бұл теңдеу адиабата теңдеуі болып табылады, яғни квазистатикалық адиабатты процесті сипаттайтын графиктің теңдеуі (22-сурет). 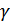 тұрақтысы адиабаттық тұрақты деп аталады. Менделеев-Клапейрон теңдеуін ескеретін болсақ адиабата теңдеуін тағы да екі түрде жазуға болады:
тұрақтысы адиабаттық тұрақты деп аталады. Менделеев-Клапейрон теңдеуін ескеретін болсақ адиабата теңдеуін тағы да екі түрде жазуға болады:
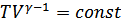 (26.5)
(26.5)
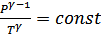 (26.6)
(26.6)
 болғандықтан (26.5) теңдеуден адиабаталық сығылғанда газ қызатыны, ал адиабаталық ұлғайғанда салқындайтындығы шығады. Газдың адиабаталық сығылғанда қызуы, бұл процесте газ үстінен жұмыс атқарылып, оның ішкі энергиясының артатындығымен түсіндіруге болады. Идеал газдың ішкі энергиясы тек қана температураға тәуелді болғандықтан, ішкі энергияның артуы температураның артуына алып келеді.
болғандықтан (26.5) теңдеуден адиабаталық сығылғанда газ қызатыны, ал адиабаталық ұлғайғанда салқындайтындығы шығады. Газдың адиабаталық сығылғанда қызуы, бұл процесте газ үстінен жұмыс атқарылып, оның ішкі энергиясының артатындығымен түсіндіруге болады. Идеал газдың ішкі энергиясы тек қана температураға тәуелді болғандықтан, ішкі энергияның артуы температураның артуына алып келеді.
2. Адиабата теңдеулері (26.4)-(26.6) казистатикалық адиабатты процеске ғана тиісті. Квазистатикалық емес адиабатты процестер үшін бұл теңдеулерді қолдануға болмайды. Адиабатты қабырғалары бар, адиабатты қалқанмен теңдей екіге бөлінген цилиндрді қарастырайық. Осы цилиндрдің бір жағында ғана газ болсын. Егер қалқанды бір мезетте алып тастаса, онда газ адиабатты бостыққа қарай ұлғаяды. Бұл процесс квазистатикалық емес. Бастапқыда газдың күрделі жойқын макроскопиялық қозғалысы туып, газ өте тепе-теңсіз күйде болады.Бұл қозғалыстардың кинетикалық энергиясы газдың ішкі үйкелісі құбылысына байланысты оның ішкі энергиясына айналады. Соңында осы көлемдегі газ белгілі температураға және тығыздыққа ие болып, тепе-теңдік күйге келеді. Осы процесс кезінде газ жұмыс атқармады және газға жылу мөлшері берілген жоқ, сондықтан газдың ішкі энергиясы да өзгеріссіз қалды. Джоуль заңына сәйкес газдың соңғы температурасы бастапқыдай болуы керек. Газдың бастапқы және соңғы күйлері үшін адиабата теңдеуін (26.5) қолдану дұрыс болмайды. Егер бұл теңдеуді осы процеске қолдансақ, газ салқындайды деген қате қорытындыға келер едік.
Бақылау сұрақтары:
1. Қандай процесті адиабаттық процесс деп атайды?
2. Адиабаттық процесс үшін термодинамиканың 1-ші бастамасы қалай жазылады?
3. Пуассон теңдеуін қорытып шығар.
4. Адиабата көрсеткіші 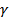 қалай анықталады?
қалай анықталады?
5. Адиабаталық процесті сипаттайтын қисықтың формасы қандай?
§27. Газ көлемінің адиабаталық өзгерісі кезіндегі жұмыс
Өткен тақырыптағы ( §26) адиабата теңдеуін қолданып газдың адиабаталық ұлғаюы немесе сығылуы кезіндегі жұмысты табуға болады.
| P |
| V |
| 1 |
| V2 |
| V1 |
| 0 |
| 23-сурет. |
| 2 |
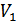 ден
ден 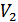 -ге дейін ұлғаюы кезіндегі жұмысын анықтайық. Газ көлемі
-ге дейін ұлғаюы кезіндегі жұмысын анықтайық. Газ көлемі 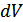 -ға өзгергенде элементар жұмыс былай анықталады:
-ға өзгергенде элементар жұмыс былай анықталады: 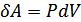
Газ қысымы мен көлемі арасындағы байланыс адиабата теңдеуімен анықталады. Процесс квазистатикалық болуы үшін, ұлғаю адиабата бойымен жүруі керек (23-сурет):
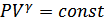
Бұл теңдеуді мына түрде жазуға болады:
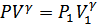 ,
,
мұнда 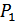 -газдың бастапқы қысымы,
-газдың бастапқы қысымы, 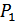 бастапқы көлемі. Бұдан
бастапқы көлемі. Бұдан
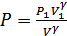 .
.
Қысымның осы өрнегін жұмыстың формуласына қойып, мынадай өрнек аламыз:
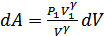 .
.
Жұмысты анықтау үшін осы өрнекті 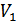 ден
ден 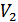 -ге дейінгі аралықта интегралдаймыз:
-ге дейінгі аралықта интегралдаймыз:
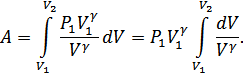
Осы өрнектегі интеграл былай анықталады:
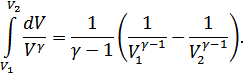
Күй теңдеуінен 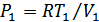 екенін ескерсек, онда жұмысты мына түрде анықтаймыз:
екенін ескерсек, онда жұмысты мына түрде анықтаймыз:
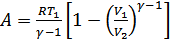 .(27.1)
.(27.1)
(26.5) теңдеуге сәйкес 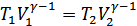 болғандықтан
болғандықтан 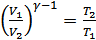 . Сондықтан, көлем адиабатты ұлғайғанда жұмысты мына түрде де анықтауға болады:
. Сондықтан, көлем адиабатты ұлғайғанда жұмысты мына түрде де анықтауға болады:
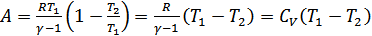 (27.2)
(27.2)
Соңғы формулада 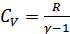 екендігі ескерілген.
екендігі ескерілген.
Сонымен, адиабаттық ұлғаю кезінде газ изотермиялық ұлғаю кезіндегіге қарағанда аз жұмыс атқаратындығын анықтадық. Адиабаттық ұлғаю кезінде атқарылған жұмыс 23-суреттегі штрихталған ауданға тең болады.
Бақылау сұрақтары:
1. Адиабатты ұлғайған газдың жұмысын анықтаңыз.
2. Адиабатты ұлғайған газдың жұмысы мен изтермиялы ұлғайған газдың жұмысын салыстырыңыз.
3. Роберт Майер теңдеуін және 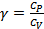 қатынасын қолданып
қатынасын қолданып 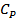 және
және 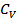 жылусиымдылықтарын
жылусиымдылықтарын 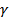 және
және 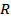 арқылы өрнектеңіз.
арқылы өрнектеңіз.
§28. Политроптық процесс
Біз қарастырған газ күйінің өзгеруінің изотермиялық және адиабаталық процестеріидеалданған процестер болып табылады. Изотермиялық процесс кезінде жүйенің қоршаған ортамен немесе термостатпен идеалды жанасуы талап етілсе, адиабаталық процесс кезінде жүйенің қоршаған ортадан идеалды оқшаулануы талап етіледі. Бұл екі процесті политроптық процесс деп аталатын жалпы процестің дербес жағдайлары деп қарастыруға болады.
Егер термодинамикалық процестер кезінде газдың жылусыйымдылығы тұрақты болып қалса, онда мұндай процесс политроптық процесс деп аталады. Кез келген политроптық процесс үшін 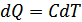 .
.
Политроптық процессті сипаттайтын политропа теңдеуін анықтайық. Термодинамиканың бірінші бастамасына сәйкес
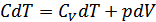 ,
,
бұл теңдеуді ықшамдасақ
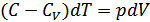 . (28.1)
. (28.1)
Идеал газ күйінің теңдеуінен 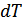 -ны өрнектейміз (§26қара):
-ны өрнектейміз (§26қара):
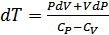 .
.
Бұл өрнекті (28.1) өрнегіне қойып және 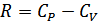 екенін ескеріп мынадай өрнек аламыз:
екенін ескеріп мынадай өрнек аламыз:
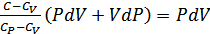 .
.
Бұл өрнекті ықшамдап мынадай өрнек аламыз:
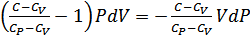 .
.
Осы өрнекті тағы да ықшамдап, айнымалыларды бөсек, онда мынадай дифференциалдық теңдеу аламыз:
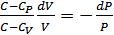 .
.
Теңдеудің сол жағындағы жылусыйымдылықтар айырымдарының қатынасын былай белгілейік:
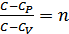 (28.2)
(28.2)
Енді алған теңдеуді интегралдап
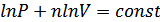 .
.
Осы теңдеуді потенцирлеу арқылы политроптық процестің теңдеуін аламыз:
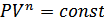 . (28.3)
. (28.3)
Политроптық процесс теңдеуіндегі (28.2) өрнекпен анықталатын 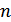 политропа көрсеткіші деп аталады.
политропа көрсеткіші деп аталады.
Политроптық процесс барлық изопроцестер және адиабаталық процесс үшін жалпы теңдеу болып табылады. Егер 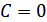 болса, онда
болса, онда 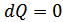 ,
, 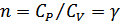 болады, демек адиабаталық процесс болып табылады. Изотермиялық процесте
болады, демек адиабаталық процесс болып табылады. Изотермиялық процесте 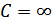 , демек
, демек 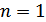 , онда
, онда 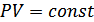 ,
, 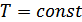 болады. Изобаралық процесс кезінде
болады. Изобаралық процесс кезінде 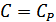 , демек
, демек 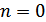 , онда
, онда 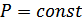 . Егер
. Егер 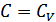 болса, онда
болса, онда 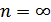 және
және 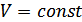 болады, демек изохоралық процесс орындалады.
болады, демек изохоралық процесс орындалады.
Бақылау сұрақтары:
1. Қандай процесті политроптық процесс деп атайды?
2. Политропа көрсеткіші қалай анықталады?
3. Политроптық процесті сипаттайтын теңдеуді қорытып шығарыңыз.
4. 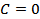 ,
, 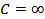 ,
, 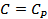 ,
, 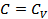 болатын процестерді талдап көрсетіңіз.
болатын процестерді талдап көрсетіңіз.
§29. Клеман және Дезорм әдісімен 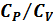 қатынасын анықтау*
қатынасын анықтау*
| К1 |
| К2 |
| сорғышқа |
| 24-сурет |
Клеман (1179-1842) және Дезорм (1777-1862) 1819 жылы газдар үшін 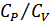 жылусыйымдылықтар қатынасын өлшеудің әдісін ұсынды. Сыйымдылығы бірнеше литр болатын шыны баллон атмосфералық қысымда ауамен толтырылады (24-сурет). Сорғыштың көмегімен баллонға тағы да ауаның біраз мөлшері толтырылып,
жылусыйымдылықтар қатынасын өлшеудің әдісін ұсынды. Сыйымдылығы бірнеше литр болатын шыны баллон атмосфералық қысымда ауамен толтырылады (24-сурет). Сорғыштың көмегімен баллонға тағы да ауаның біраз мөлшері толтырылып, 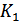 краны жабылады. Аз уақыттан соң баллондағы газдың температурасы қоршаған орта температурасымен теңескен соң оның қысымы сұйықтық манометрмен өлшенеді. Ауаның бұл қысымын
краны жабылады. Аз уақыттан соң баллондағы газдың температурасы қоршаған орта температурасымен теңескен соң оның қысымы сұйықтық манометрмен өлшенеді. Ауаның бұл қысымын 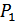 , ал температурасын
, ал температурасын 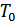 деп белгілейміз. Енді
деп белгілейміз. Енді 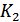 кранын аз уақытқа ашып, баллондағы газ қысымын атмосфералық қысыммен теңестіреміз, сонда баллондағы қысым
кранын аз уақытқа ашып, баллондағы газ қысымын атмосфералық қысыммен теңестіреміз, сонда баллондағы қысым 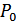 болады. Бұл кезде баллондағы газ адиабатты ұлғайып, сыртқы ауаның қысымына қарсы жұмыс атқарады. Сондықтан оның температурасы белгілі бір
болады. Бұл кезде баллондағы газ адиабатты ұлғайып, сыртқы ауаның қысымына қарсы жұмыс атқарады. Сондықтан оның температурасы белгілі бір 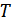 шамаға азаяды. Осы қысқа процесс барысында
шамаға азаяды. Осы қысқа процесс барысында 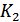 краны ашық болады. Содан кейін
краны ашық болады. Содан кейін 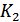 краны тез жабылып баллондағы газдың температурасы қоршаған ауа температурасымен теңеседі, ал қысымы
краны тез жабылып баллондағы газдың температурасы қоршаған ауа температурасымен теңеседі, ал қысымы 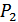 болады. Осылай өлшенген
болады. Осылай өлшенген 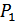 ,
, 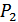 ,
, 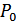 қысымдар бойынша
қысымдар бойынша 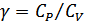 жылусыйымдылықтар қатынасы анықталады.
жылусыйымдылықтар қатынасы анықталады.
Ол үшін ыдыс ішінде ойша тұйық бетпен (қабықшамен) шектелетін газдың мөлшерін қарастырамыз. 24-суретте бұл көлем штрихталған қисықпен көрсетілген. Газдың әртүрлі процестерінде осы қабықша ішіндегі газ ұлғайып, сығылып қоршаған газға қарсы жұмыс атқарады және онымен жылу алмасады. Бұл процестер квазистатикалық болып табылады, себебі макроскопиялық қозғалыстың кинетикалық энергиясы өте аз. Сипатталған процестер кезіндегі қабықша ішіндегі газдың күйі сәйкес өзгеріп отырды деп ескереміз. Мысалы, 1-күйде – 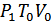 , 2-күйде –
, 2-күйде – 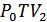 , ал 3-күйде –
, ал 3-күйде – 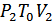 . Газ 1-күйден 2-күйге адиабатты өтеді, сондықтан бұл күйлер үшін адиабата теңдеуін жазамыз:
. Газ 1-күйден 2-күйге адиабатты өтеді, сондықтан бұл күйлер үшін адиабата теңдеуін жазамыз:
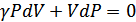
Мұндағы 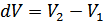 , ал
, ал 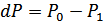 . Осыны ескерсек:
. Осыны ескерсек:
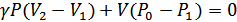 (29.1)
(29.1)
1-күймен 3-күйдегі температуралар бірдей, демек бұл күйлер үшін 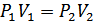 теңдігі орындалады. Олай болса
теңдігі орындалады. Олай болса 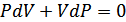 , немесе
, немесе
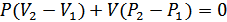 . (29.2)
. (29.2)
(29.1), (29.2) қатынастарын бірге шешсек, онда
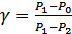 . (29.3)
. (29.3)
Бұл теңдеу бойынша 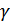 қысымдар айырымдарының қатынасы түрінде анықталады. Сондықтан қысымды кез келген бірлікте өлшеуге болады. Тәжірибеде ыңғайлысы қысымды су бағанының биіктігімен (миллиметр) өлшеген.
қысымдар айырымдарының қатынасы түрінде анықталады. Сондықтан қысымды кез келген бірлікте өлшеуге болады. Тәжірибеде ыңғайлысы қысымды су бағанының биіктігімен (миллиметр) өлшеген.
Бақылау сұрақтары:
1. Клеман және Дезорм әдісін сипаттаңыз.
2. Клеман және Дезорм тәжірибесінде газда қандай процесс орын алады?
3. Клеман және Дезорм әдісінде 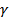 шамасы қандай параметрлер арқылы анықталады?
шамасы қандай параметрлер арқылы анықталады?
§30. Газдардағы дыбыс жылдамдығы*
1. Ньютон формуласы. Механика курсында газдардағы дыбыстың таралу жылдамдығы үшін мынадай формула қорытылып шығарылады:
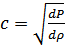 , (30.1)
, (30.1)
мұндағы 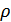 -газдың тығыздығы. Газдың қысымы
-газдың тығыздығы. Газдың қысымы 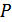 тек тығыздыққа ғана емес, температураға да тәуелді. Сондықтан
тек тығыздыққа ғана емес, температураға да тәуелді. Сондықтан 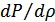 туындысын қандай мағынада түсіну керек екендігін білген дұрыс. Ньютон қысым мен тығыздық Бойль-Мариотт заңымен
туындысын қандай мағынада түсіну керек екендігін білген дұрыс. Ньютон қысым мен тығыздық Бойль-Мариотт заңымен 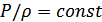 байланысқан деп ескерді. Дыбыс ортада таралғанда ауаның тығыздалған және сиреген нүктелеріндегі температура бірдей болады, демек дыбыстың газда таралуы изотермиялық процесс. Олай болса, бұл туындыны былай түсінген дұрыс:
байланысқан деп ескерді. Дыбыс ортада таралғанда ауаның тығыздалған және сиреген нүктелеріндегі температура бірдей болады, демек дыбыстың газда таралуы изотермиялық процесс. Олай болса, бұл туындыны былай түсінген дұрыс: 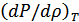 . Онда (30.1) формуласы Ньютон формуласына айналады:
. Онда (30.1) формуласы Ньютон формуласына айналады:
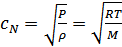 , (30.2)
, (30.2)
мұндағы 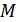 -газдың мольдік массасы, ал
-газдың мольдік массасы, ал 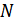 индексі дыбыс жылдамдығы Ньютон формуласымен есептелгенін көрсетеді. Енді осы формула көмегімен мольдік массасы
индексі дыбыс жылдамдығы Ньютон формуласымен есептелгенін көрсетеді. Енді осы формула көмегімен мольдік массасы 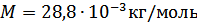 , температурасы
, температурасы 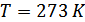 болатын ауадағы дыбыс жылдамдығын анықтайық.
болатын ауадағы дыбыс жылдамдығын анықтайық. 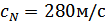 , ал тәжірибеде
, ал тәжірибеде 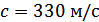 .
.
2.Лаплас формуласы. Тәжірибе мен теория арасындағы алшақтықты Лаплас (1749-1827) ескерді. Лапластың пайымдауынша дыбыс толқынындағы тығыздық пен температураның өзгерісі өте жылдам өтеді, ауаның жылу өткізгіштігі өте аз, демек мұндай процестер үшін жылу алмасудың ролі жоқ. Дыбыс толқынындағы ауаның тығыздалған және сиреген нүктелеріндегі температура тепе-теңдікке келіп үлгермейді, сондықтан дыбыстың таралу процесін адиабатты процесс деп ескеруге болады. Олай болса бұл процесс үшін изотерма теңдеуін емес адиабата теңдеуін қолдану керек. Егер адиабата теңдеуіндегі көлемді тығыздық арқылы өрнектесек, онда адиабата теңдеуін мына түрде жаза аламыз:
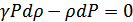 ,(30.3)
,(30.3)
Бұдан
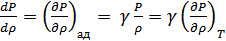 .(30.4)
.(30.4)
Осы теңдеуден Лаплас теңдеуін аламыз:
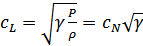 .(30.5)
.(30.5)
Бұл теңдеу Ньютон формуласымен есептелген жылдамдыққа қарағанда 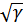 есе көп жылдамдықты береді. Ауа үшін
есе көп жылдамдықты береді. Ауа үшін 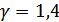 . Лаплас формуласына сәйкес температурасы
. Лаплас формуласына сәйкес температурасы 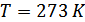 ауадағы дыбыс жылдамдығы:
ауадағы дыбыс жылдамдығы:
 2015-04-30
2015-04-30 4289
4289
