Нитрование – это химический процесс, внедрения нитрогруппы (NO2) в молекулу органического вещества, причем нитрогруппа обязательно должна быть связана с атомом углерода углеродной цепи.
Нитрование парафинов в условиях электрофильного замещения не дает положительных результатов. Это становится возможно только при высокой температуре, т. как это способствует образованию свободных R. В первые этот процесс был проведен русским химиком М. Коноваловым, который нагрел метана до Т=130-150ºС с НNО3 в запаянной трубе.
Другими методами нитрования парафинов является:
1. Нитрование в газовой фазе (Т=350-500ºС, ω (НNО3) = 40-70%).
2. Нитрование в жидкой фазе (Т=100-200ºС, ω (НNО3) = 50-70%).
3. Нитрование в жидкой и газовой фазе при использовании N2О4, как нитрующего агента.
При нитровании парафинов нитрогруппа NO2 может вступать в любое положение в исходном у/в, замещая атом водорода, причём реакционная способность углеродных атомов в этом случае изменяется: третичный > вторичный > первичный.
При повышении температуры реакционная способность углеродных атомов выравнивается, в этом случае образуется смесь изомерных нитросоединений, причем, изомеризация углеродного скелета не наблюдается.
Наличие нитрогруппы в молекуле парафина препятствует дальнейшему замещению. Однако при жидкофазном нитровании (2) происходит образование динитропроизводных. Вторая нитрогруппа внедряется в положение наиболее удаленное от первой, а также может внедрятся и к тому атому углерода к которому прикреплена первая. Это явление объясняется, тем что первая нитрогруппа дезактивирует те атомы водорода, которые соединены с соседними атомами углерода: СН3 – СН(NО2) – СН3 + НNО3 → СН3 – С(NО2) 2 – СН3 + Н2О
Если процесс нитрования проводят в газовой фазе (1) получают смесь низших нитропроизводных, которые образуются в результате деструкции углеродной цепи:
СН3NО2 + NО2 – СН(СН3)–С2Н5
+НNО3
СН3 – СН(СН3) - СН2 - СН3 __________ ↑ → СН3 – СН(NО2) – СН3 + СН3 – СН2 - NО2
↑t, газ ↓
NО2
↑
СН3NО2 + СН3 – С (СН3)– СН2 - СН3
Этот процесс называется деструктивным нитрованием. Он возможен в основном для парафинов с линейной углеродной цепью и чем длиннее цепь, тем более значительна деструкция. Разветвленные парафины менее способны к деструктивному нитрованию.
Механизм реакции нитрования парафинов: свободно-радикальный, состоит из трёх основных стадий:
1. Образование свободных радикалов происходит в результате разрушения связи между
азотом и кислородом: НО: NО2 НО∙ + ∙NО2
2. Рост цепи происходит за счёт атаки образовавшимся R молекулы парафина:
А)R: Н + ∙ОН → R∙ + Н2О
R: Н + ∙NО2 → R∙ + НNО2
Б)R∙ + НО: NО2 → R – NО2 + ∙ ОН
3. Обрыв цепи взаимодействие между свободными радикалами: R∙ + R∙ → R- R∙ +
Побочные реакции нитрования парафинов следующие:
1.Деструктивное нитрование, особенно опасно для газофазного процесса.
2.Крекинг парафинов с образованием смеси парафинов и олефинов с меньшим числом атомов углерода в цепи.
3.Окисление парафинов до карбоновых кислот, кетонов альдегидов, СО2, СО и др., так как азотная кислота- сильный окислитель, причём процесс окисления усиливается с ↑Т.
4.Образование нитрилов: R∙ + ∙NО2 → R: ОNО
5.Образование спиртов: R∙ + НО: NО2 → R – ОН + ∙NО2
Нитропарафины применяются в качестве растворителей и приобрели большое значение как промежуточные продукты органического синтеза. Из них получают нитроспирты, аминоспирты, нитроолефины, ряд новых взрывчатых веществ и тд.
Для нитрования аренов применяют следующие агенты:
1. азотную кислоту, чистую, но она является слабым агентом нитрования, так как в ходе реакции она разбавляется образующейся водой.
2.нитрующую смесь (НNО3 + Н2SО4), где Н2SО4 – выполняет следующие функции: катализатора, водоотнимающего средства и вещества способствующего более полному использованию НNО3 и препятствующему окислительным процессам.
3.ацетилнитрат СН3СООNО2 и бензоилнитрат С6Н5СООNО2, которые используют в растворах ССI4 или СН3СООН, при низкой температуре (0—15 °С).
4. оксиды азота NO2 и N2O4 также могут служить агентами нитрования в присутствии Н2SO4 (или катализатора): 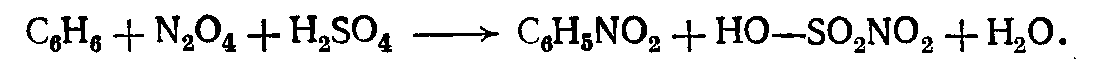
Реакции нитрования сильноэкзотермичны.
Механизм реакции нитрования аренов – это электрофильное замещение, состоит из следующих стадий:
1.кислотно-основное взаимодействие, ведущее к образованию очень активного нитрующего агента – иона нитрония (NО2): 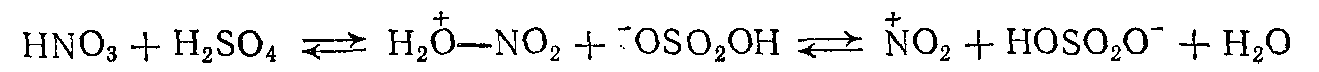
2.образовавшийся ион нитрония атакует арен, происходит образование π – комплекса, затем выделение нитросоединения с отщеплением протона:
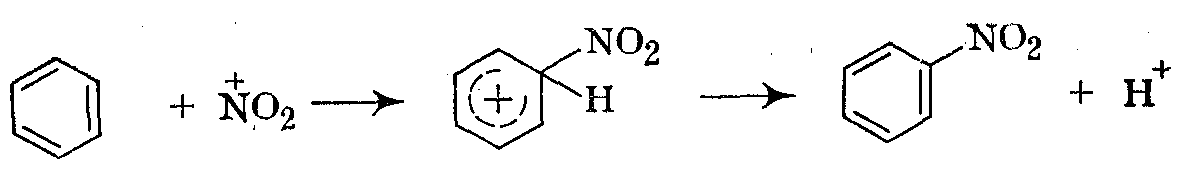
Влияние заместителей на реакционную способность ароматического ядра и ориентацию вступающей нитрогруппы такое же, как при других реакциях электрофильного замещения в ароматическое ядро. Ввиду значительного дезактивирующего влияния нитрогруппы каждая последующая стадия нитрования протекает значительно медленнее предыдущей. Поэтому реакцию можно осуществить с высоким выходом любого из продуктов последовательно-параллельного замещения (моно-, ди- или тринитропроизводных), подбирая соответствующие силу нитрующего агента и температуру.
Побочными реакциями при нитровании аренов являются:
1.Окисление азотной кислотой до бензойной кислоты, СО2 и СО.
2.Образование ди- и тринитропроизводных.
Ароматические нитросоединения применяются как взрывчатые вещества и промежуточные продукты для получения главным образом аминов, а также в качестве в производстве красителей, пластмасс, синтетических волокон, душистых веществ, лекарственных соединений, средств защиты растений и т.д.
 2015-04-20
2015-04-20 2048
2048







