Процессы дегидрирования связаны с отщеплением водорода от молекул органических веществ. Напротив, гидрирование – химические превращения веществ, состоящее в присоединении водорода к этим веществам. Гидрирование-дегидрирование часто это пара обратимых реакций: СН3 – СН3 ↔ СН2 = СН2 + Н2.
Реакции гидрирования можно разделить на несколько групп.
1.Каталитическое гидрирование, или присоединение водорода по месту кратных связей (С==С, С≡С, С=N, Салиф.—Сар. и т. д.). Изменяя условия проведения реакции, можно получать частично или полностью насыщенные водородом соединения:
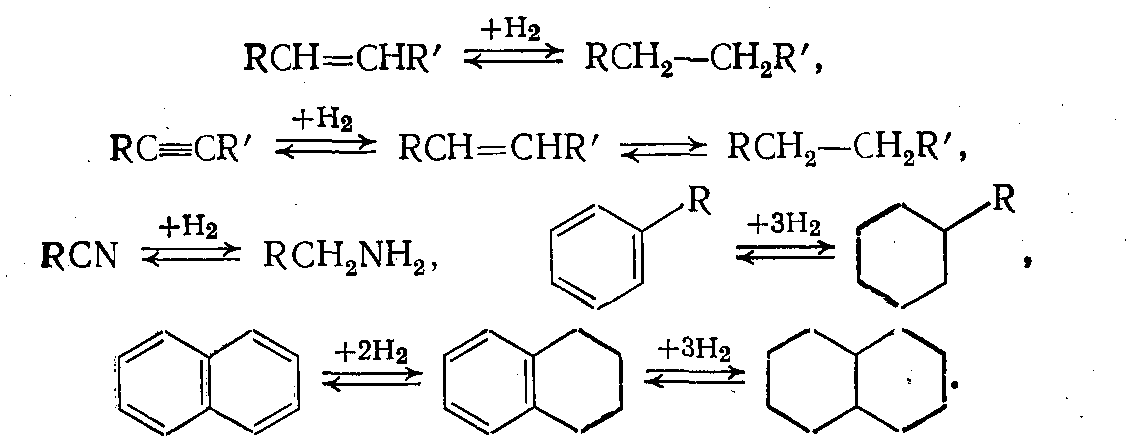
2. Присоединение водорода к гетероатомным соединениям без вытеснения или с вытеснением этих гетероатомов в виде воды, сероводорода, аммиака и т. д. (например, гидрирование альдегидов и кетонов до спиртов; гидрирование азот-, кислород- или серосодержащих соединений с выделением аммиака, воды, сероводорода соответственно — так называемый процесс гидроочистки):
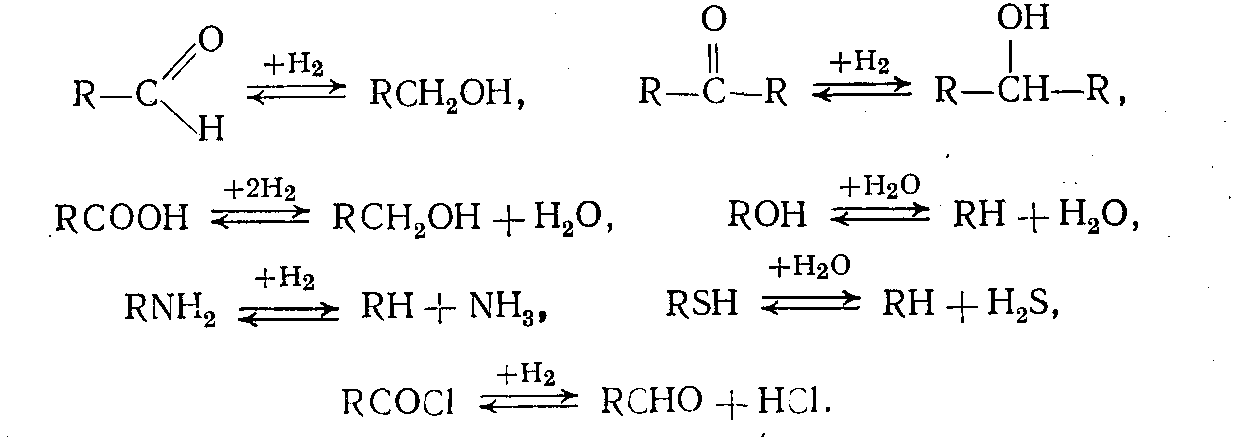
3. Деструктивное гидрирование (гидрогенолиз, гидрокрекинг) — процесс, сопровождающийся расщеплением углерод-углеродных связей, причем получающиеся осколки молекул присоединяют водород, образуя насыщенные соединения меньшей молекулярной массы:
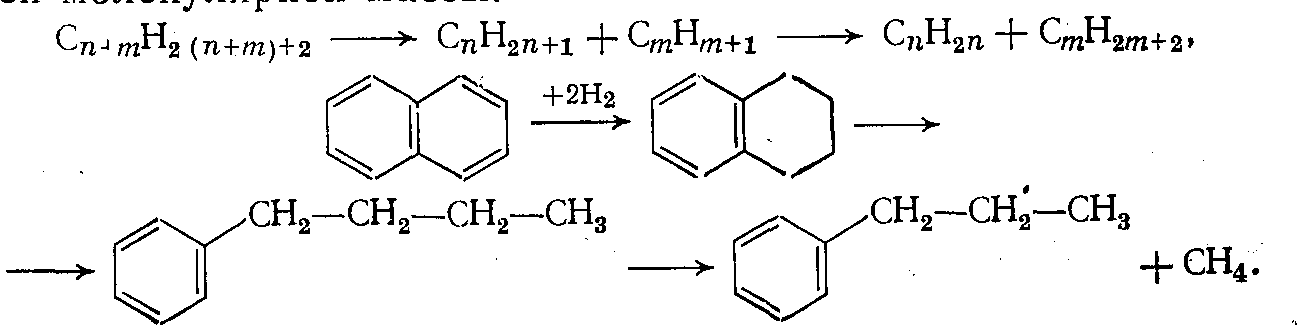
4. Реакции сопряженного гидрирования — дегидрирования, т. е. перераспределение водорода между двумя молекулам без участия молекулярного водорода:
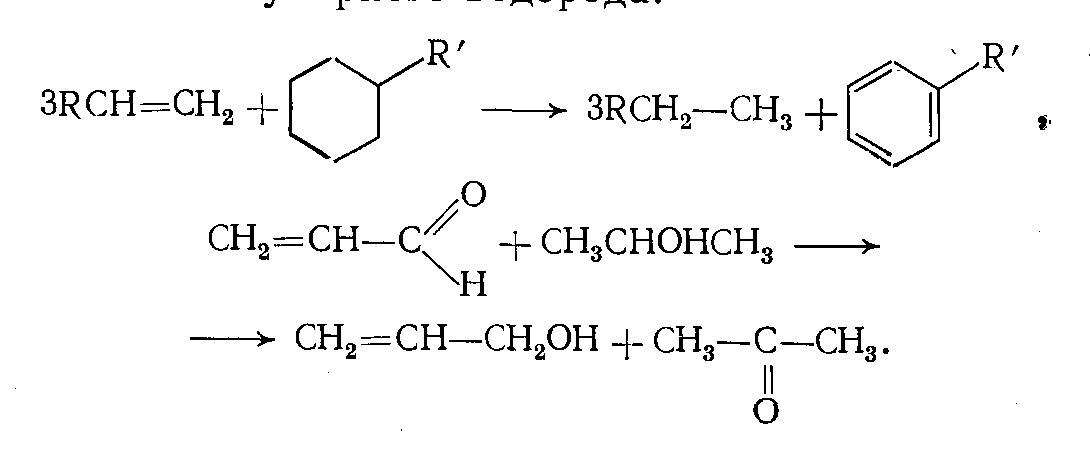
Каталитическое гидрирование осуществляется в присутствии некоторых металлов или их оксидов, которые активируют водород или переводят его в атомарное состояние (в молекулярном состоянии водород неактивен). Некаталитическое гидрирование практически не проводят, так как энергия диссоциации связи Н—Н очень высока (435 кДж/моль).
Многие органические соединения при нагревании в присутствии катализаторов способны выделять водород, превращаясь при этом в ненасыщенные соединения.
Каталитическое дегидрирование подробно изучал Н. Д. Зелинский с сотрудниками. Реакции каталитического дегидрирования очень многочисленны и разнообразны. Их можно классифицировать следующим образом:
1) дегидрирование углеводородов;
2) дегидрирование кислородсодержащих соединений;
3) дегидрирование азотсодержащих соединений.
Процессы дегидрирования очень тесно связаны с процессами гидрирования, и, по существу, они являются системой обратимых превращений.
Реакции гидрирования протекают с выделением тепла, а дегидрирования — с поглощением тепла. С учетом только термодинамических факторов способность к гидрированию для различных соединений уменьшается в ряду:
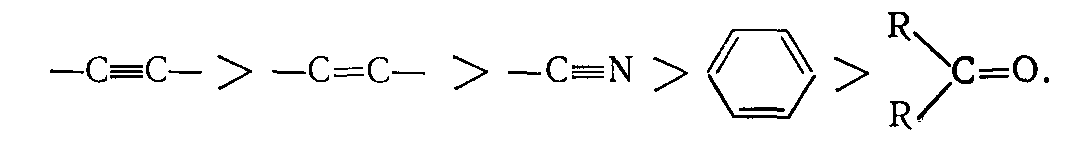
Теплота реакции гидрирования зависит от класса исходного соединения (теплоты реакций дегидрирования, обратных соответствующим реакциям гидрирования, имеют ту же абсолютную величину, но противоположны по знаку):
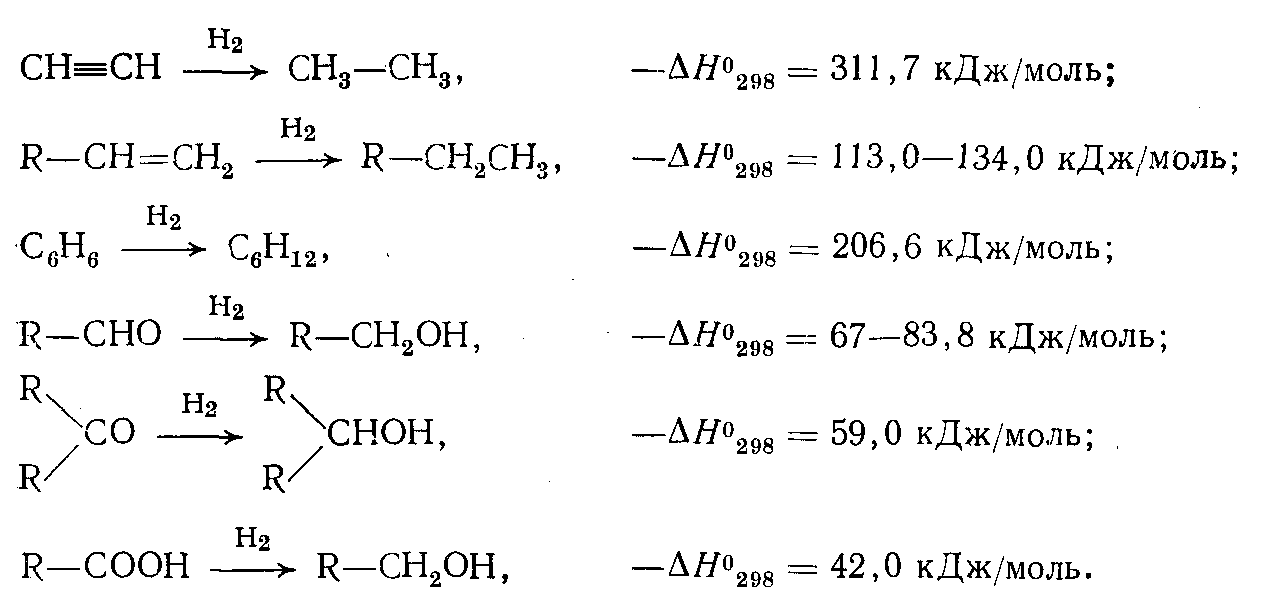
Реакции дегидрирования и гидрирования широко используются в промышленности для получения топлива, синтетического каучука, циклогексана, получение олефинов С2—С4, высших изоолефинов из парафинов, получение бутадиена и изопрена, стирола, ацетилена и некоторые другие.
Применяемые для процессов гидрирования и дегидрирования катализаторы можно разделить на следующие группы:
1. Металлы VIII группы 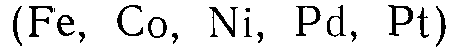 и 1 группы
и 1 группы 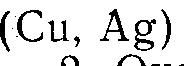 ;
;
2. Оксиды металлов 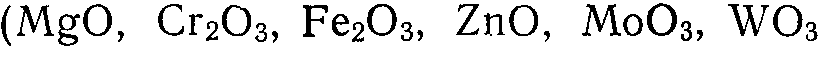 и др.);
и др.);
3. Сульфиды металлов 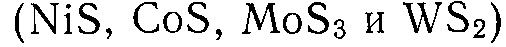 ;
;
4. Сложные катализаторы, состоящие из двух и более металлов 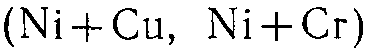 , оксидов
, оксидов 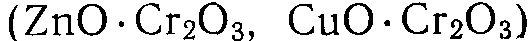 , сульфидов
, сульфидов 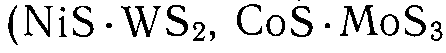 .
.
Обычно катализаторы используют:
-в диспергированном виде (коллоидные Рd, Ni и др.); такие катализаторы получают путем термического разложения или восстановления солей соответствующих металлов непосредственно в реакционной массе;
-в измельченном или таблетированном виде; такие катализаторы получают осаждением из солей с последующей промывкой, сушкой, прокаливанием;
-на носителях; такие катализаторы получают восстановлением оксидов, осажденных на поверхность носителя.
Температура оказывает на скорость гидрирования (в отличие от дегидрирования) небольшое влияние. Обычно при повышении температуры на 30—50 0С скорость примерно удваивается, что соответствует энергии активации 5—10 ккал/моль (21—42 кДж/моль).
По способности к гидрированию разные классы соединений располагаются в следующие ряды:
Олефины> Ацетилены > Ароматические углеводороды
Адьдегиды> Кетоны> Нитрилы> Карбоновые кислоты.
Гидрирование можно проводить при самых различных условиях: в газовой или в жидкой фазе, с растворителем или без него, при температурах от —100 до +500°С и давлениях от 0,1 до 1∙107кПа в зависимости от активности катализатора, причем в случае катализаторов с низкой активностью высокую температуру сочетают с высоким давлением.
Реакция дегидрирования обратима, идет с поглощением тепла и увеличением объема (за счет выделения водорода) по общей схеме:
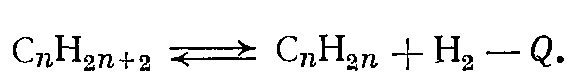
По принципу Ле Шателье смещению равновесия вправо способствуют высокая температура и низкое давление.
Теоретически дегидрирование может протекать при 200 °С и выше, но при этом увеличивается продолжительность времени нагревания реакционной массы, что способствует вторичным реакциям расщепления. При температурах выше 700°С скорость дегидрирования возрастает, но одновременно ускоряются и реакции расщепления, причем во много раз быстрее, чем реакции дегидрирования. Оптимальной температурой дегидрирования является 500—650 °С, что определяет осуществление процесса в газовой фазе.
Применение катализаторов позволяет увеличить скорость дегидрирования при сравнительно низкой температуре, когда еще не получили развития вторичные реакции.
от нескольких месяцев до 1—2 лет.
Механизм реакций гидрирования и дегидрирования: Эти процессы относятся к типу гомолитических превращений, в принципе подобных гетерогеннокаталитическим реакциям окисления. Важную роль играет хемосорбция реагентов на активных центрах (К), при которой за счет электронных переходов с участием катализатора ослабляются или полностью разрываются химические связи в адсорбированной молекуле. Так, разными методами показано, что, когда водород сорбируется металлами, за физической адсорбцией следует частичное ослабление связей и затем диссоциация молекулы:
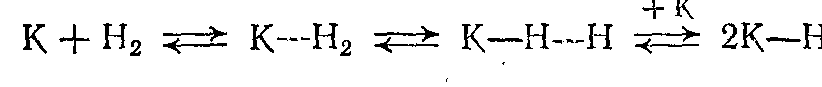
Насыщенные углеводороды сорбируются в меньшей степени, но для них также возможна диссоциация по С—Н-связи:
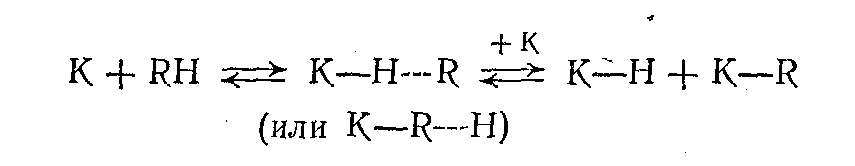
Олефины, ароматические соединения и в еще большей мере ацетилен и его гомологи обладают высокой способностью к сорбции, которая протекает в основном за счет частичного или полного раскрытия ненасыщенной связи:
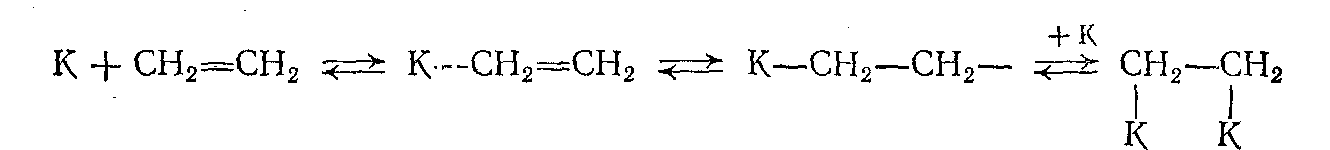
Окисные катализаторы ведут себя подобным же образом, но их способность к хемосорбции водорода и углеводородов меньше, чем у металлов. Органические кислородсодержащие и азотистые соединения лучше сорбируются на окисных катализаторах, чем на металлах.
Дальнейшее взаимодействие протекает между двумя хемосорбированными частицами, находящимися на соседних активных центрах поверхности, или между хемосорбированной частицей и физически адсорбированной или налетающей из объема молекулой. При этом в равновесных процессах гидрирования-дегидрирования обратима каждая элементарная стадия:
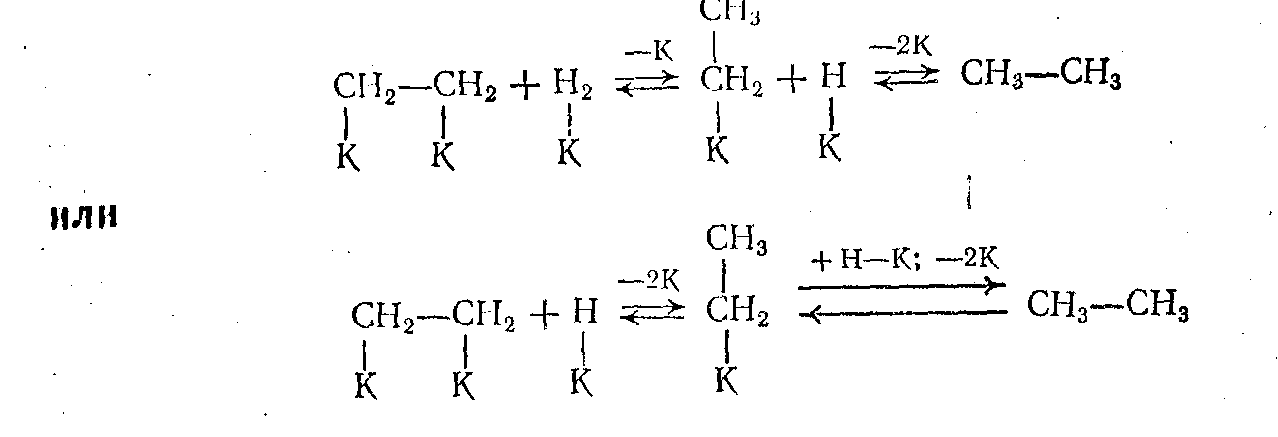
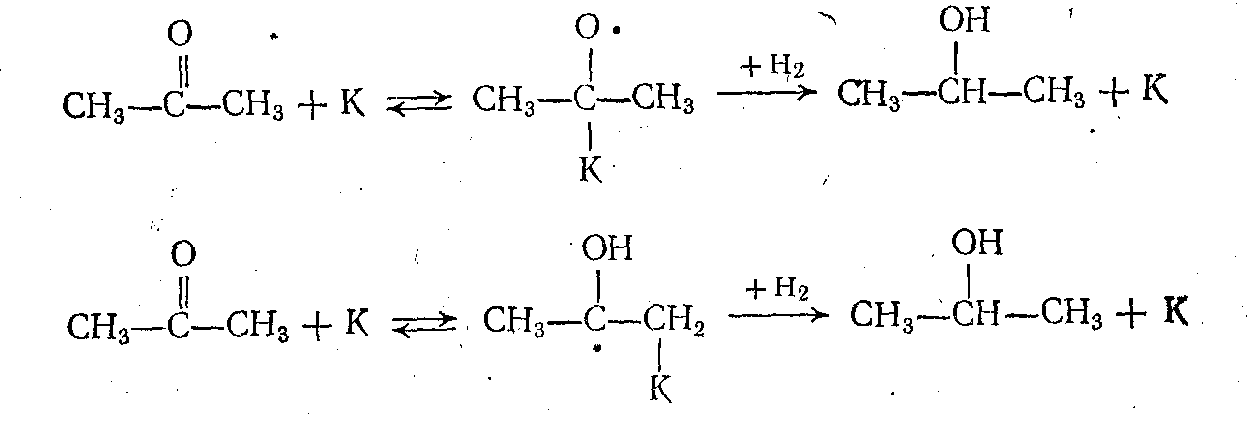
Реакции гидрирования карбонильных соединений и дегидрирования спиртов имеют некоторые особенности. Для них возможен карбонильный механизм с хемосорбцией по С—О- связи, а также енольный механизм, когда реакция протекает по С—С-связи и включает стадию енолизации карбонильного соединения. Опыты с мечеными веществами показали, что при низкой температуре преобладает первый, а при более высокой — второй механизм:
 2015-04-20
2015-04-20 6377
6377
