В этом случае реакция заканчивается установлением химического равновесия и равновесная смесь содержит как продукты реакции, так и остаток исходных веществ. Пусть к моменту установления равновесия образовалось, например, х моль продукта С – это опорное вещество, то
a A + в В «с С + d D
| Начало реакции: | 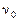 моль моль
| 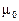 моль моль
| ||
| Равновесие: | 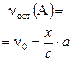
| 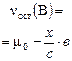
| 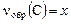
| 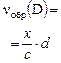
|
Пример 1. Раствор, содержащий 20,0 г гидроксида натрия поглотил 6,72 л углекислого газа (н. у.). Определите продукты реакции и их количества.
При поглощении раствором щелочи кислотных оксидов (СО2 , SO2 , P2O5 и др.) или водородных соединений (H2S и др.), которым соответствуют многоосновные кислоты, на первом этапе при избытке щелочи всегда образуются средние соли, которые на втором этапе при наличии избытка поглощаемого реагента частично или полностью переходят в кислые соли:
СО2 (газ) + 2 NaOH = Na2CO3 + Н2О
| начало реакции: | 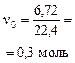
| 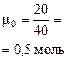
| ||
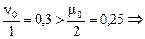 углекислый газ в избытке углекислый газ в избытке
| ||||
| окончание реакции: | 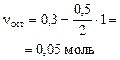
| 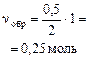
|
Остаток углекислого газа реагирует с карбонатом натрия:
Na2CO3 + СО2 (газ) + Н2О = 2 NaHСО3
| начало реакции: | 0,25 моль (избыток) | 0,05 моль (недостаток) |
| окончание реакции: | 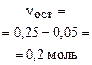
| 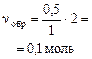
|
Итак, в растворе присутствует смесь солей: 0,1 моль NaHCO3 и 0,2 моль Na2CO3.
Пример 2. В стакан с 200 мл раствора фосфорной кислоты с молярной концентрацией 0,5 моль/л внесли 6 г гидроксида натрия. Определите состав раствора после окончания реакции.
При нейтрализации щелочью (NaOH, KOH, NH3 и др.) многоосновных кислот происходит последовательное замещение атомов водорода на металл или аммонийную группу и состав продуктов реакции зависит от соотношения количеств реагентов. В нашем случае, если 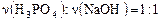 – образуется NaH2PO4; если 1: 2, то Na2HPO4 и если 1: 3, то Na3PO4. В промежуточных вариантах возникает смесь солей.
– образуется NaH2PO4; если 1: 2, то Na2HPO4 и если 1: 3, то Na3PO4. В промежуточных вариантах возникает смесь солей.
Найдем исходные количества реагентов: 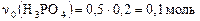 ;
; 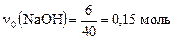 , – имеет место промежуточный вариант между 1: 1 и 1: 2, поэтому реакция идет в два этапа:
, – имеет место промежуточный вариант между 1: 1 и 1: 2, поэтому реакция идет в два этапа:
H3PO4 + NaOH = NaH2PO4 + H2O
| начало реакции: | 0,1 моль (недостаток) | 0,15 моль (избыток) | |
| окончание реакции: | 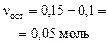
| 0,1 моль |
далее остаток щелочи реагирует с NaH2PO4
NaH2PO4 + NaOH = Na2HPO4 + H2O
| начало реакции: | 0,1 моль (избыток) | 0,05 моль (недостаток) | ||
| окончание реакции: | 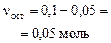
| 0,05 моль | ||
Итак, в растворе после реакции присутствует смесь солей – по 0,05 моль NaH2PO4 и Na2HPO4 .
Успех в проведении расчетов по цепочкам химических уравнений в случае, когда продукт одной реакции является исходным веществом для другой, зависит от правильного выбора последовательности переходов от одного уравнения к другому. Выбрав согласно условию задачи опорное вещество, стрелками удобно указать последовательность расчета, помня при этом, что вещество, полученное в предыдущей реакции, в том же количестве используется в последующей если, естественно, в ходе всего многостадийного процесса нет потерь и выход каждой реакции 100 %.
Пример 3. Сколько литров хлора и водорода (н.у.) необходимо для получения хлороводорода, способного нейтрализовать раствор щелочи, образующийся при растворении в воде 13,7 г бария.
Составим уравнения всех реакций и стрелками укажем последовательность расчета:
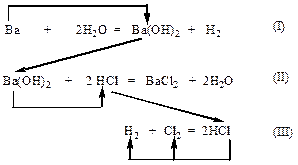 |
Опорное вещество барий и его количество
n(Ва) = 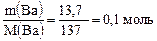 .
.
Цепочка расчетов:
уравнение (I) - n(Ba(OH)2/ I) = 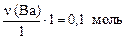 =>
=>
уравнение (II) - n(HCl / II) 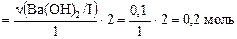 => уравнение (III) –
=> уравнение (III) –
n(Cl2) = n(H2) = 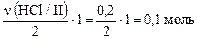 ,
,
тогда V(H2) = V(Cl2) = 0,1 моль· 22,4 л/моль = 2,24 л.
При решении задач на смеси веществ необходимо прежде всего для каждого компонента смеси отдельно записать все химические реакции, в которых он может участвовать в соответствии с условием задачи. В качестве опорных веществ обычно выбирают вещества исходной смеси и их количества (число молей) обозначают как неизвестные – x, y, z, …., а затем составляют уравнения материального баланса по количеству, массе или объему (для газов) участников химических реакций, где два последних необходимо выразить через неизвестные. Число балансовых уравнений должно быть равно числу неизвестных. На последнем этапе решается полученная система алгебраических уравнений.
Пример 4. При сгорании 13,44 л (н. у.) смеси водорода, метана и угарного газа образовалось 8,96 л углекислого газа и 14,4 г воды. Определить количества газов в смеси.
Уравнения реакций:
2H2 + O2 = 2H2O (I)
CH4 + 2O2 = CO2 + 2H2O (II)
2CO + O2 = 2CO2 (III)
Опорные вещества – CH4, H2 и CO; обозначим их количества
ν(H2) = x; ν(СH4) = y; ν(CO) = z.
Составим три балансовых уравнения по числу неизвестных:
а) баланс по объему смеси:
V (H2) + V(CH4) + V(CO) = 13,44 л, введем в него неизвестные:
xVm + yVm + zVm = 13,44 или x + y + z = 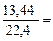 0,6 моль;
0,6 моль;
б) баланс по количеству CO2:
ν(CO2/ II) + ν(CO2/ III) = νобщ.(CO2), но
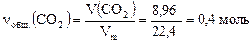 ;
;
ν(CO2/ II) = ν(CH4) = y; ν(CO2/ III) = 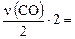 z, тогда y + z = 0,4.
z, тогда y + z = 0,4.
в) баланс по количеству H2O:
ν(H2O/ I) + ν(H2O/ II) = νобщ.(H2O), но
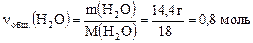 ,
,
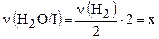 ;
; 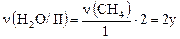 ,
,
тогда x + 2y = 0,8.
Итак, получаем систему уравнений вида
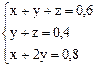 ,
,
которая легко решается устно
x = 0,2 моль; y = 0,3 моль; z = 0,1 моль.
 2015-04-30
2015-04-30 698
698








