1. В основе расчета количества вещества, плотности и молярной концентрации газообразных веществ и их смесей при заданных давлении Р и температуре Т лежит уравнение Менделеева-Клапейрона:
РV = nRT, откуда Р = (n/V)× RT = CRT или
РV = m/M × RT, откуда Р = (m/V) × RT/M = r × RT/M,
где r, г/л – плотность, а С, моль/л – молярная концентрация газа при данных Р и Т.
В приведенных уравнениях численное значение газовой постоянной R зависит от используемой системы единиц, поэтому в практических расчетах важно следить за размерностью физических величин согласно следующим рекомендациям:
P[атм] × V[л] = n[моль] × 0,082 [л × атм /моль × К] × Т[K] или
P[кПа] × V[л] = n[моль] × 8,314 [Дж /моль × К] × Т[K],
причем 1атм = 760 мм рт.ст. = 101,325 кПа и Т[K] = 273 + t 0C
Следствия из уравнения Менделеева - Клапейрона:
а) Закон Авогадро: при одинаковых условиях (Р,Т– фиксированы) равные объемы газов содержат одинаковое число молекул:
если для двух газов V1 = V2, то n1 = n2 и наоборот.
б) Молярные объемы Vm любых газов и их смесей при одинаковых условиях одинаковы, то есть
при n = 1 моль, получаем Vm = RT/P
В частном случае при н.у.
(Т = 273К = 00С; Р = 1 атм = 101,325 кПа)
Vm (н.у) = 0,082 × 273 / 1 = 22,4 л/моль
Таким образом, n = V/ Vm = V(н.у) / 22,4
в) Необходимо различать два понятия:
– плотность газа или смеси газов r, г/л – это масса 1л газа или смеси, откуда М = r × RT/P = r × Vm,
и при н.у. М [г/моль] = r [г/л] × 22,4 л/моль
– относительная плотность газов, показывающая во сколько раз один газ тяжелее или легче другого при одинаковых условиях:
DA (B) = r (B) / r (A) = M(B)/M(A),
где А – газ сравнения (часто это водород М(Н2) = 2 г/моль или воздух 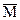 = 29 г/моль)
= 29 г/моль)
2. Смеси газов:
а) состав газовой смеси задают с помощью объемных (ji) или мольных (х i) долей компонентов, величины которых совпадают:
ji = Vi / Vобщ = ni × Vm / nобщ × Vm = ni /nобщ. = х i,
причем S ji = 1 и S х i = 1
б) Среднюю молярную массу смеси газов рассчитывают по формуле: Мсм = S Мi ji = S Мi х i,
где Мi [г/моль] – молярная масса i – го газа смеси, а суммирование ведут по всем компонентам газовой смеси.
Важно помнить, что Мi(min) < 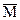 см < Мi(max), то есть средняя молярная масса всегда лежит в интервале между молярными массами самого легкого и самого тяжелого газов в смеси.
см < Мi(max), то есть средняя молярная масса всегда лежит в интервале между молярными массами самого легкого и самого тяжелого газов в смеси.
Например, сухой воздух имеет состав
j(N2) =78%; j (O2) = 21% и j(Ar) = 1%,
тогда его средняя молярная масса равна
Мвозд. = 0,78 × М(N2) + 0,21 × М(O2) + 0,01 × М(Ar)
= 0,78 × 28 + 0,21 × 32 +0,01 × 40 = 28,96 г/моль.
в) Законы Дальтона (1805 г.) и Амага (1893 г.):
– давление 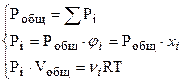 ,
,
где Рi – парциальное давление i-газа.
– объем 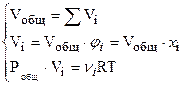 ,
,
где Vi – парциальный объем i-го газа.
3. Если в химической реакции участвуют газообразные вещества
а А(газ) + в В(газ) = с С(газ) + d D(газ),
то при фиксированных температуре и давлении стехиометрические коэффициенты задают объемные пропорции, в которых реагируют и образуются вещества:
Vпр.(А): Vпр. (В): Vобр (С): Vобр(D) = а: в: с: d,
а основное расчетное уравнение примет вид:
Vпр.(А)/ а = Vпр. (В)/ в = Vобр. (С)/ с = Vобр.(D)/ d
Пример 1. Гидразин при умеренном нагревании разлагается, образуя либо смесь простых веществ, либо продуктов диспропорционирования азота. Некоторые металлы ускоряют одну из этих реакций, другие – обе указанные реакции. При полном разложении гидразина в присутствии металлического родия образуется газовая смесь с плотностью 0,260 г/л (1 атм, 227 ОС). В аналогичных условиях в присутствии меди образуется смесь с плотностью 0,418 г/л. Металлический кобальт приводит к образованию газовой смеси с относительной плотностью по гелию 4,8. Определите состав продуктов реакции для каждого из катализаторов.Рассчитайте мольную долю гидразина, распадающегося на простые вещества, если металл катализирует обе реакции. (Зональный тур олимпиады 2003 г.)
Реакции разложения гидразина имеют вид:
N2H4 = N2 + 2 H2 (I)
3 N2- 2H4 = 4 N-3H3 + N20 (II)
При полном разложении 1 моль гидразина по реакции (I) образуется три моля продуктов – 1 моль N2 и 2 моль H2 и средняя молярная масса полученной газовой смеси равна:
М1 = М (N2) × 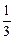 + М (Н2) ×
+ М (Н2) × 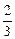 = 28 ×
= 28 × 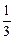 + 2 ×
+ 2 × 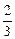 = 10,66 г/моль.
= 10,66 г/моль.
Аналогично, при полном разложении 3 моль гидразина по реакции (II) образуется пять молей продуктов – 1 моль N2 и 4 моль NH3 и средняя молярная масса полученной газовой смеси равна:
М2 = М (NH3) × 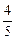 + М (N2) ×
+ М (N2) × 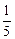 = 17 ×
= 17 × 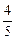 + 28 ×
+ 28 × 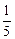 = 19,2 г/моль.
= 19,2 г/моль.
Рассчитаем средние молярные массы газовых смесей, полученных в эксперименте, и сравним их с приведенными выше:
а) Катализатор – родий.
MRh = 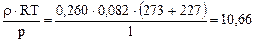 г/моль,
г/моль,
что свидетельствует о протекании реакции (I).
б) Катализатор – медь. Аналогично, MCu = 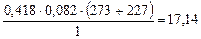 г/моль и, следовательно, медь катализирует обе реакции, поскольку М1 < MCu < M2.
г/моль и, следовательно, медь катализирует обе реакции, поскольку М1 < MCu < M2.
в) Катализатор – кобальт.
МСо = Dвозд(смесь)× М(Не) = 4,8 × 4 = 19,2 г/моль,
и, таким образом, кобальт катализирует реакцию (II).
Определим долю гидразина, распадающегося в присутствии меди по реакции (I). Пусть полностью разлагается один моль гидразина, из которого x моль – по реакции (I) и (1- x) моль – по реакции (II), тогда образуется:
n(N2) = n(N2/ I) + n(N2/ II) = x + (1- x)/3 = (1+2 x)/3,
n(H2/ I) = 2 x, n(NH3/ II) = (4-4 x)/3 и
nобщ = (1+2 x)/3 + 2 x + (4-4 x)/3 = (5+4 x)/3.
Из уравнения для средней молярной массы смеси газов
MCu = М (N2)× 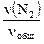 + М (NH3)×
+ М (NH3)× 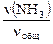 + М (Н2) ×
+ М (Н2) × 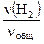
получаем 17,14 = 28× 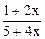 + 17×
+ 17× 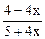 + 2×
+ 2× 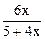 ,
,
откуда находим x = 0,15. Таким образом, в присутствии меди 15% гидразина распадается по реакции (I) и 85% - по реакции(II).
 2015-04-30
2015-04-30 924
924








