Теплоемкостьюлюбого тела или определенного количества вещества, называется величина, равная количеству тепла, которое необходимо сообщить телу, чтобы нагреть его на один кельвин (1 K= 10 C). Теплоёмкость тела измеряется в Дж/К. Каждое вещество, в том числе каждый газ, можно охарактеризовать удельной и молярной теплоёмкостью.
Удельной теплоёмкостью газа 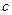 называется физическая величина, равная количеству тепла, которое нужно сообщить единице массы газа, чтобы повысить его температуру на один кельвин. Единицей удельной теплоёмкости является Дж/(кг×К).
называется физическая величина, равная количеству тепла, которое нужно сообщить единице массы газа, чтобы повысить его температуру на один кельвин. Единицей удельной теплоёмкости является Дж/(кг×К).
Молярной теплоёмкостью газа С называется величина, равная количеству тепла, необходимого для нагрева одного моля газа на один кельвин. Измеряется молярная теплоёмкость в Дж/(моль×К).
Моль – единица количества вещества. За 1 моль принято количество вещества, содержащее столько же атомов, молекул, ионов и т. д., сколько атомов содержится в 0,012 кг изотопа углерода C 12. Это число частиц, содержащееся в моле любого вещества, называется числом Авогадро и равно 6,022 ×1023 моль -1.
Масса вещества, взятого в количестве одного моля, называется молярной массой и обозначается μ. В округленных числах молярная масса водорода равна 0,002 кг/моль, кислорода – 0,032 кг/моль и т. д.
Используя понятие молярной массы, можно установить связь между молярной и удельной теплоёмкостью:
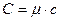 (5)
(5)
Теплоемкость в общем случае является характеристикой, как тела, так и условий нагревания. Она приобретает определенные числовые значения, если фиксировать условия нагревания.
Наибольший интерес представляет теплоёмкость тех случаев, когда теплота передаётся газу при постоянном объёме и при постоянном давлении. В соответствие с этим вводят удельную и молярную теплоёмкость при постоянном объёме 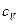 ,
, 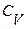 и при постоянном давлении
и при постоянном давлении 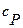 ,
, 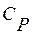 .
.
Покажем, что 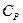 >
> 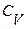 , то есть получим уравнение Майера
, то есть получим уравнение Майера 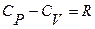 . Смысл этого уравнения заключается в том, что при изобарическом нагревании газа на один градус к газу должно быть подведено больше тепла, чем для такого же изохорического нагревания.
. Смысл этого уравнения заключается в том, что при изобарическом нагревании газа на один градус к газу должно быть подведено больше тепла, чем для такого же изохорического нагревания.
Рассмотрим изохорическое и изобарическое нагревание одного моля газа. Для одного моля газа уравнение состояния имеет вид:
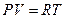 (6)
(6)
При изохорическом нагревании газ не расширяется и, следовательно, не производится работы. Вся переданная газу теплота идет на увеличение внутренней энергии. Эту энергию обозначим через 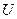 ,она включает в себя кинетическую энергию теплового движения молекул идеального газа, а в реальном газе, кроме того, учитывается потенциальная энергия взаимодействия молекул друг с другом.
,она включает в себя кинетическую энергию теплового движения молекул идеального газа, а в реальном газе, кроме того, учитывается потенциальная энергия взаимодействия молекул друг с другом.
Из определения внутренней энергии следует, что она имеет вид вполне определенное значение в любом состоянии системы. Это означает, что внутренняя энергия 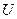 является функцией состояния.
является функцией состояния.
Величины 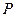 ,
, 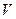 ,
, 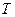 , так же как и
, так же как и 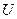 имеют вполне определенные значения в любом состоянии системы и характеризуют это состояние. Поэтому
имеют вполне определенные значения в любом состоянии системы и характеризуют это состояние. Поэтому 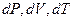 - являются полными дифференциалами.
- являются полными дифференциалами.
Теплоемкость при постоянном объеме определяется как
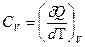 (7)
(7)
Применим первое начало термодинамики в виде
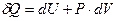 (8)
(8)
к изохорическому процессу 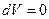 , тогда (8) имеет вид
, тогда (8) имеет вид
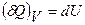 (9)
(9)
Это означает, что 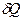 при V=const – полный дифференциал. Тогда из (9) и (7) следует
при V=const – полный дифференциал. Тогда из (9) и (7) следует
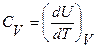 (10)
(10)
При изобарическом нагревании газ расширяется и совершает работу
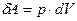
При P=const, (8) запишем в виде
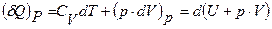 (11)
(11)
Это означает, что 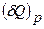 - полный дифференциал и
- полный дифференциал и
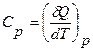 (12)
(12)
Тогда из определения (12) и формулы (11) получаем
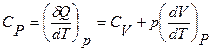 (13)
(13)
Так как уравнение состояния имеет вид (6),то
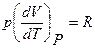 ,
,
что при подстановке в (13) дает уравнение Майера
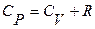 (14)
(14)
 2015-05-05
2015-05-05 336
336








