Строение и распределение электронной плотности в молекуле фенола можно изобразить следующей схемой:
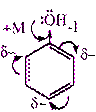
Гидроксильная группаявляется заместителем 1 рода, т.е. электроно-донорным заместителем.
Это обусловлено тем, что одна из неподеленных электронных пар гидроксильного атома кислорода вступает в р,π-сопряжение с π-системой бензольного ядра, проявляя +М-эффект.
С другой стороны, гидроксильная группа, вследствие большей электроотрицательности кислорода, проявляет –I-эффект.
Однако +М-эффект в фенолах значительно сильнее противоположно направленного –I-эффекта (+М > -I).
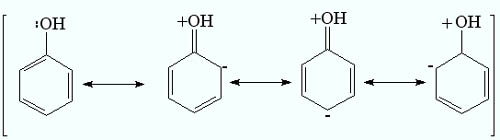
Результатом эффекта сопряжения является:
1) увеличение полярности связи О-Н, приводящее к усилению кислотных свойств фенолов по сравнению со спиртами;
2) вследствие сопряжения связь С-ОН у фенолов становится короче и прочнее в сравнении со спиртами, так как носит частично двойной характер. Поэтому затрудняются реакции замещения ОН-группы;
3) повышение электронной плотности на атомах углерода в орто- и пара-положениях бензольного ядра облегчает реакции электрофильного замещения атомов водорода в этих положениях.
 2015-05-05
2015-05-05 2617
2617








