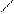




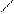


 OH O
OH O
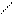


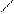


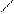 SO3H (HL1)
SO3H (HL1)
НО3S HO3S SO3H
Реакцию проводят в кислой среде при нагревании.
В кислой среде кобальт (II) окисляется до кобальта (III), а последний взаимодействует с HL1 и образует внутрикомплексное соединение состава СоL31:
Со3+ + 3 HL1 = CoL31↓ (красный) + 3 Н+
При больших концентрациях из раствора выпадает красный осадок.
Катионы кобальта Со2+ с нитритом калия KNO2 в уксуснокислой среде образуют (после окисления до Со3+) желтый кристаллический осадок гексанитрокобальтата (III) калия K3[Co(NO2)6]; по этой реакции катионы кобальта можно открыть в присутствии катионов никеля.
Соединение Со2+ с бурой Na2B4O7*10H2O образуют перлы синего цвета, с рубеановодородной кислотой NH2CSCSNH2 – желто-бурый осадок комплексного соединения.
6.4. Аналитические реакции катиона никеля (II) Ni2+.
Аквокомплексы никеля (II)[Ni(H2O)6]2+ окрашены в зеленый цвет, поэтому водные растворы солей никеля (II) имеют зеленую окраску. В растворе никель (II) присутствует только в форме комплексных соединений.
1. Реакция с щелочами.
Ni2+ + 2 OH- → Ni(OH)2↓(зеленый)
· Осадок Ni(OH)2 растворяется в растворах кислот и аммиака:
Ni(OH)2 + 2 Н+ → Ni2+ + 2 H2О
Ni(OH)2 +6 NH3 → [Ni(NH3)6]2+ + 3 OH-
2. Реакция с аммиаком.
Ni(NO3)2 + NH3*H2O → NiOHNO3 + NH4NO3,
NiCl2 + NH3*H2O → NiOHCl + NH4Cl
2NiSO4 + 2 NH3*H2O → Ni(OH)2SO4 + (NH4)SO4,
Признаки реакции: выпадают зеленые осадки.
Добавляют по каплям при перемешивании концентрированный (25%-й) раствор аммиака до полного растворения осадка и образования раствора синего цвета:
NiOHCl + 6 NH3 → [Ni(NH3)6]2+ + OH- + Cl-
Оксисоль Ni(II) гексамминникель (II) катион
Осторожно нагревают смесь и прибавляют к ней по каплям концентрированный раствор KBr до выпадения фиолетового осадка [Ni(NH3)6]Br2.
· Комплексы [Ni(NH3)6]Cl2, [Ni(NH3)6](NO2)2, [Ni(NH3)6]SO4 хорошо растворяются в воде, а остальные малорастворимы в воде.
3. Реакция с реактивом Чугаева (диметилглиоксимом).
O …… H-O
 |  |



 Н3С-С=N-OH Н3С-С=N N=C-CH3
Н3С-С=N-OH Н3С-С=N N=C-CH3
 Ni2++ → Ni + 2 Н+, при рН≈6-9
Ni2++ → Ni + 2 Н+, при рН≈6-9

 Н3С-С=N-OH Н3С-С=N N=C-CH3
Н3С-С=N-OH Н3С-С=N N=C-CH3


О-Н…….. О
Розово-красный
Бис-диметилглиоксиматоникель (II)
Реакцию проводят в среде аммиака.
· Осадок растворяется в сильных кислотах и щелочах, нерастворим в растворах аммиака.
4. Реакция с сульфид - ионами.
Ni2+ + S2- → NiS↓ (черный)
Катионы Ni2+ с тиоцианатом калия KNCS и пиридином (Py) образуют голубой осадок комплекса состава [NiPy](NCS)2; со смесью щелочи и хлорной воды – черно-бурый осадок гидроксида Ni (III) Ni(OH)3; с рубеановодородной кислотой –сине-фиолетовый осадок рубеаната никеля малорастворимый в кислотах и аммиаке.
6.5. Аналитические реакции катиона ртути (II) Hg2+.
Акво - ионы ртути (II) [Hg(H2O)n]2+ в водных растворах бесцветны. Все соединения ртути (II) сильно ядовиты, поэтому при работе с ними следует принимать меры предосторожности!
1. Реакция с щелочами (фармакопейная).
Hg2+ + 2 OH- → HgO↓(желтый) + Н2О
· Осадок HgO растворяется в азотной кислоте, в растворах хлоридов и иодидов щелочных металлов с образованием соответственно Hg(NO3)2, HgCl2 и комплекса [HgI4]2-:
HgO + 2 HNO3 → Hg(NO3)2 + H2O
HgO +2 Cl- + H2O → HgCl2 + 2 OH-
HgO +4 I- + H2O → [HgI4]2- + 2 OH-
2. Реакция с аммиаком.
HgCl2 + 2 NH3 → HgNH2Cl↓(белый) + NH4Cl
2 Hg(NO3)2 + 4 NH3 + H2O → [OНg2NH2]NO3↓(белый) + 3 NH4NO3
· Осадки растворяются (лучше – при нагревании) в избытке аммиака; но только в присутствии солей аммония, с образованием бесцветного комплексного катиона тетрамминртути (II) [Нg(NH3)4]2+.
· После выпадения осадков в пробирки добавляют по 3-4 капли водного раствора соли аммония (NH4Cl или NH4NO3) и по каплям – водный раствор аммиака при перемешивании до полного растворения осадков:
HgNH2Cl + 2 NH3 + NH4+ → [Нg(NH3)4]2+ + Cl-
[OНg2NH2]NO2 + 4 NH3 +3 NH4+ → 2 [Нg(NH3)4]2+ +NO3- + H2O
3. Реакция с иодидом калия (фармакопейная).
Hg2+ + 2 I- → HgI2↓(красный)
HgI2 + 2 I- → [HgI4]2- (бесцветный)
4. Реакция с сульфид - ионами (фармакопейная).
Реакция протекает в несколько стадий. Вначале образуется белый осадок, постепенно изменяющий окраску через желто – красную и бурую на коричнево-черную при избытке сульфид – ионов.
3 HgCl2 + 2 H2S → 2 HgS * HgCl2↓(белый) + 4 HСl
2 HgS * HgCl2 + H2S → 3 HgS↓(коричнево-черный) + 2 НСl
Аналогично протекает реакция HgCl2 с сульфидом натрия Na2S.
· HgS не растворяется в разбавленной азотной кислоте, но растворим в царской водке (смесь HCl +HNO3).
3 HgS +6 HСl + 2 HNO3 → 3 HgCl2 + 2 NO + 3S + 4 H2O
5. Реакция с хлоридом олова (II).
Катионы Hg2+ восстанавливается олово (II) вначале до Hg22+, а затем – до металлической ртути Hg0.
2 Hg2+ + [SnCl4]2- + 4 Cl- → Hg2Cl2↓(белый) + [SnCl6]2-
Hg2Cl2 + [SnCl4]2- → 2 Hg0 (темный) + [SnCl6]2-
6. Реакция с металлической медью.
Катионы Hg2+ восстанавливаются металлической медью до металлической ртути.
Hg2+ + Cu0 → Hg0 (темный) + Cu2+
Признаки реакции: На медную поверхность наносят каплю раствора соли ртути (II). На поверхности возникает темное пятно, которое при протирании фильтровальной бумагой становится серебристо-блестящим.
7. Реакция с хромат – ионами.
Hg2+ + CrO42- → HgCrO4↓(желтый)
Катионы Hg2+ с ортофосфат – ионами образуют белый осадок Hg3(PO4)2; с дифенилкарбазидом и дифенилкарбазоном – комплекс сине-фиолетового цвета; с дитизоном – желто-оранжевый или красный комплекс, в зависимости от условий проведения реакции.
 2015-05-06
2015-05-06 3036
3036








