6.2. Аналитические реакции катиона кадмия Cd2+.
Акво – ионы кадмия [Cd(H2O)n]2+ в водных растворах бесцветны.
1. Реакция с щелочами и аммиаком.
Cd2+ + 2 OH- → Cd(OH)2↓(белый)
· Осадок Cd(OH)2 нерастворим в избытке щелочи, но растворяется в избытке аммиака с образованием бесцветного аммиачного комплекса [Cd(NH3)4]2+:
Cd(OH)2 + 4 NH3 → [Cd(NH3)4]2+ + 2 OH-
Осадок Cd(OH)2 растворяется в кислотах:
Cd(OH)2 + 2 H3О+ → [Cd(H2О)4]2+
2. Реакция с сульфид – ионами.
Реакцию проводят в слабо кислых или щелочных растворах.
Cd2+ + S2- → CdS↓(желтый)
·. Осадок CdS не растворим в щелочах и в растворе сульфида натрия, частично растворяется в насыщенном растворе хлорида натрия с образованием хлоридного комплекса кадмия [CdCl4]2-:
CdS + 4 Cl- → [CdCl4]2- + S2-
· CdS нерастворим в кислотах, за исключением HCl, в которой он растворяется с образованием хлоридного комплекса кадмия:
CdS + HCl → H2[CdCl4] +H2S
3. Реакция с тетраиодовисмутатом (III) калия.
Cd2+ + 2 [BiI4]- → CdI2 + 3BiI3 ↓(черный)
Признаки реакции: На фильтровальной бумаге появляется черное пятно. При добавлении по каплям раствора иодида калия или тиосульфата натрия черное пятно исчезает.
|
|
|
4. Реакция с тетрароданомеркуратом (II) аммония.
Cd2+ + [Hg(SCN)4]2- → Cd[Hg(SCN)4]
Признаки реакции:Выпадают бесцветные (или белые) кристаллы тетрароданомеркурата (II) кадмия Cd[Hg(SCN)4].
Реакцию можно проводить как микрокристаллоскопическую.
Cd2+ реагирует с комплексоорганическими реагентами:
дитизоном, кадионом, β-нафтохинолином, меркаптобензимидазолом, меркаптобензтиазолом и т.д.
6.3. Аналитические реакции катиона кобальта (II) Cо2+.
Акво – ионы кобальта (II) октаэдрической структуры [Cо(H2О)6]2+ окрашены в розовый цвет, поэтому разбавленные водные растворы солей кобальта (II) также имеют розовую окраску. Однако при выпаривании водных растворов Cо2+ их окраска меняется на синюю, характерную для комплексов кобальта (II) тетраэдрической структуры.
Соединения Со(II) легко окисляется до соединений Со (III), причем в ряде случаев – уже кислородом воздуха (растворенным в воде), что необходимо учитывать при проведении качественных реакций на кобальт (II). В водных растворах кобальт (II) и кобальт (III) присутствуют исключительно в форме комплексных соединений. Комплексы Со(III) устойчивее комплексов Со (II).
1. Реакция с щелочами.
CоCl2 + OH- → CoOHCl↓(синий) + Cl-
CoOHCl + OH- → Co(OH)2↓(розовый) + Cl-
Если к розовому осадку Со(ОН)2 прибавить Н2О2, то реакция окисления Со(ОН)2 в черно-бурый Co(OH)3 протекает практически мгновенно:
2 Co(OH)2 + Н2О2 → 2 Co(OH)3 (черно-бурый).
Действие смеси Н2О2 со щелочью на раствор соли кобальта (II) сразу приводит к образованию черно-бурого осадка Co(OH)3:
2 CоCl2 + 4 OH- + Н2О2 → 2 Co(OH)3 + 4 Сl-
2. Реакция с аммиаком.
CоCl2 + NH3*H2O → CoOHCl↓(синий) + NH4Cl
|
|
|
CoOHCl + 5 NH3 + NH4Cl → [Co(NH3)6]Cl2 (желтый) + H2O
При стоянии на воздухе, раствор постепенно меняет окраску на вишнево – красную, за счет окисления кобальта (II) до кобальта (III) с образованием хлоропентамминкобальт (III) – анионов [Co(NH3)5Сl]2- вишнево – красного цвета:
2 [Co(NH3)6]Cl2 + O2 + 2 H2O → 2 [Co(NH3)5Сl](OH)2 + 2 NH3
В присутствии Н2О2 и солей аммония реакция окисления [Co(NH3)6]2+ до [Co(NH3)5Сl]2+ протекает практически мгновенно:
2 [Co(NH3)6]Cl2 + 2 H2O2 + 2 NH4Cl → 2 [Co(NH3)5Сl]Cl2 +4 NH3 + 2 H2O
3. Реакция с тетратиоцианатомеркуратом (II) аммония (тетрароданомеркуратом (II) аммония).
Cо2+ + [Hg(SCN)4]2- → Cо[Hg(SCN)4]↓(темно-синие кристаллы)
Из разбавленных растворов кристаллы выделяются медленно.
4. Реакция с тиоцианат – ионами.
Co2+ + 4 NCS- ↔ [Co(NСS)4]2+ (синий)
Реакцию проводят в слабо кислой среде.
v Комплекс в водных растворах неустойчив и равновесие комплексообразования смещено влево в сторону образования розового аквокомплекса кобальта (II). Поэтому реакцию проводят при избытке тиоцианат – ионов, чтобы сместить равновесие вправо. Равновесие смещается вправо также в водно – ацетоновых растворах, в силу чего реакцию иногда проводят в водно – ацетоновой среде (ацетон хорошо смешивается с водой).
v В растворах органических растворителей (изоамиловый спирт, эфир) устойчивость комплекса повышается, поэтому при проведении данной реакции водный раствор, содержащий катионы Co2+, смешивают с небольшим количеством органического растворителя (смесь изоамилового спирта и диэтилового эфира). При этом [Co(NCS)4]2+ переходит в органическую фазу и окрашивает ее в синий цвет.
5. Реакция с сульфид – ионами.
Со2+ + S2- → CoS ↓(черный)
· Осадок CoS растворяется в минеральных кислотах, однако при стоянии он превращается в форму, трудно растворимую в разбавленной HCl, но растворимую в кислотах в присутствии окислителей.
6. Реакция с солями цинка – образование «зелени Ринмана».
Zn(NO3)2 + Co(NO3)2 → CoZnO2 + 4 NO2 + O2
Признаки реакции: При смачивании полоски фильтровальной бумаги горячим раствором, высушивании ее и озолении в фарфоровом тигле на спиртовой горелке образуется зола зеленого цвета.
7. Реакция с реактивом Ильинского (1-нитрозо-2-нафтол).
Реакцию проводят в нейтральной или слабо кислой среде. 1-нитрозо-2-нафтол в растворе может существовать в двух таутомерных формах, условно обозначаемых через HL:


 NO N - OH
NO N - OH
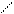


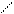

 ОН O
ОН O
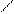


(HL)
В этой реакции вначале кобальт (II) окисляется до кобальт (III), который с 1-нитрозо-2-нафтолом образует внутрикомплексное соединение, выделяющееся в виде пурпурно-красного осадка:
Со3+ + 3 HL → CoL3 + 3 H+
8. Реакция с нитрозо- R- солью (фармакопейная).
Нитрозо – R – соль можно представить в двух таутомерных формах:
 2015-05-06
2015-05-06 3714
3714
