Протокол №1. Оцінення контролю якості готових лікарських засобів, контролю термінів придатності ліків; оцінення основних показників лікарських речовин користуючись вимогами НТД
1. Здійснити види контролю індивідуально виготовлених лікарських форм та реєструвати їх результати у відповідних журналах (органолептичний, фізичний, хімічний). Визначити стабільність лікарських засобів при зберіганні протягом встановлених термінів придатності. Перевірити ліки, у яких закінчився термін придатності на можливість подовження терміну їх подальшого застосування у медичній практиці, оформляти відповідний паспорт якості.
На дослідження поступила лікарська форма:
Розчину глюкози 10% - 100 мл
Кислоти аскорбінової 1,0
Згідно Наказу України №626 Органолептичний контроль є обов'язковим видом контролю і полягає в перевірці зовнішнього вигляду лікарського засобу, у тому числі якості закупорювання, його кольору, запаху, однорідності змішування, відсутності механічних включень у рідких лікарських формах.
Дана лікарська форма – розчин прозорого кольору, солодкуватий на смак.
Фізичний контроль полягає в перевірці загальної маси або об'єму лікарського засобу, кількості та маси окремих доз, що входять в цю лікарську форму (але не менше трьох доз).
- кожна серія фасовки та внутрішньоаптечної заготовки в кількості трьох - п'яти одиниць фасовки або одиниць заготовки;
- лікарські засоби, вироблені за індивідуальними рецептами, замовленнями (вимогами), вибірково протягом робочого дня з урахуванням усіх видів лікарських форм, вироблених за день;
- лікарські засоби, що вимагають стерилізації, після розфасовки до їх стерилізації;
- лікарські засоби для дітей віком до 1 року;
- лікарські форми, призначені для новонароджених, до їх стерилізації.
Загальний об'єм лікарської форми – 100 мл, в якому 10,0г глюкози, 1,0г кислоти аскорбінової.
Хімічний контроль полягає в ідентифікації та визначенні кількісного вмісту лікарських речовин, що входять до складу лікарського засобу.
І д е н т и ф і к а ц і я.
Метод виявлення глюкози заснований на її здатності окислюватися: до розчину додають кислоту нітратну розведену та розчин срібла нітрату – випадає сірий металічний осад срібла:
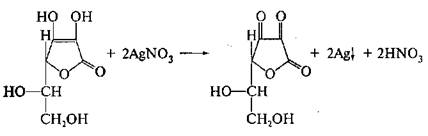
Оскільки аскорбінова кислота є сильнішим відновником, ніж глюкоза, для ідентифікації останньою в даній лікарській формі необхідно заздалегідь окислити аскорбінову кислоту: 0,05—0,1 г суміші розчиняють в 1—2 мл води, додають по 2—3 краплі пергідролю і розчину аміаку і кип'ятять 2—3 мл. Після охолоджування додають реактив Фелінга і знову нагрівають; утворюється цегляний-червоний осад.
Кількісне визначення кислоти аскорбінової:
Масу 1 порошку розчиняють в мірному циліндрі на 5 мл, доводять об'єм розчину водою до мітки і перемішують. У 2 мл приготованого розчину визначають аскорбінову кислоту алкаліметричним методом, пряме титрування, індикатор – фенолфталеїн.
Відсотковий вміст кислоти аскорбінової (Х) розраховуємо за формулою:
X=VТ∙ .K ∙ T∙100 / Н
де: VТ - об’єм розчину натрію гідроксиду 0,1 М витраченого на титрування, мл;
K - коефіцієнт поправки до молярності розчину натрію гідроксиду 0,1 М;
T - титр розчину натрію гідроксиду 0,1 М за речовиною, г/мл:
T = S . См / 1000
М.м. – молярна маса речовини, г / моль;
См - молярність титрованого розчину натрію гідроксиду, моль / л;
Н - маса лікарської форми, взята на аналіз, г.
Кількісне визначення глюкози проводимо методом рефрактометрії:
Вимірюють показник заломлення води (nо) і приготованого розчину (n). Вміст глюкози (X) в грамах розраховують по формулі:
Х = [(n – n0) – С . F] . 100 / 0,00142 . (100 - в)
де: С — концентрація аскорбінової кислоти, знайдена шляхом тит-
рування (в %);
0,00142 — чинник показника заломлення безводої глюкози;
F — чинник показника заломлення аскорбінової кислоти
відповідний знайденій концентрації;
в — вміст вологи в глюкозі (в %).
2. Скласти аналітичний паспорт якості враховуючи результати проведеного контролю ГЛФ. Визначити стабільність лікарських засобів при зберіганні протягом встановлених термінів придатності. Перевірити ліки, у яких закінчився термін придатності на можливість подовження терміну їх подальшого застосування у медичній практиці, оформляти відповідний паспорт якості.
АНАЛІТИЧНИЙ ЛИСТОК від ____________
Аналітик:
Назва препарату: Бралрозчин для інєкцій
Реєстраційний номер зразка:
Виробництво: виробник Мікро ЛАБС Лімітед Сілко", Індія
Номер серії: РП.№Р.08.01/03563
Одержано від:
Дата одержання:.
Вид контролю:
АНД. відповідно до якої проводили анализ:
| ПОКАЗНИКИ | ВИМОГИ НТД | РЕЗУЛЬТАТЫ |
| Опис | Прозорий жовтуватий розчин | відповідає |
| Ідентичність | Реакція на метамізол натрію з розчином хлораміну УФ спект розчииу препарату повинен мати Д максимум при λ=290±2нм (пітофенону гідрохлорид) | позитивна |
| рН | 6,0-7,5 | 6,4 |
| Прозорістъ | Препарат повинен бути прозорим, або не мутніше еталону | відповідає |
| Кольоровість | Забарвлення препарату повинно бути не інтеясив-ніше за забарвлення еталону ВУ4 | відповідає |
| Пакування | відповідає | |
| Маркування | відповідає |
ВИСНОВКИ: Перевірений зразок Бралрозчин для інєкцій 5мл № 5, с., виробник Мікро ЛАБС Лімітед Сілко", Індія, відповідає вимогам НТД до РП.№Р.08.01/03563.
За перевіриними показниками __________________________________________
3. Визначити наявність сторонніх речовин (домішок) у сировинні, матеріалах, напівпродукції. Проводити контроль води очищеної, для ін’єкцій, отриманої з питної води, хімічними та інструментальними методами, а також інших розчинників.
ВОДА ОЧИЩЕНА
Aqua purificata
WATER, PURIFIED
Н20 M.m. 18.02
Вода очищена — це вода для приготування лікарських засобів, крім тих, які мають бути стерильними й апіро-геннимн, якщо немає інших зазначень і дозволів компетентного уповноваженого органу.
Вода очищена "in bulk"
ВИРОБНИЦТВО
-- Воду очищену одержують із води питної дистиляцією, іонним обміном або будь-яким іншим підхожим способом.
Під час виробництва і подальшого зберігання належним чином контролюють і відстежують загальне число життєздатних аеробних мікроорганізмів. Для простежування несприятливих тенденцій установлюють підхожу попереджувальну межу і підхожу межу, шо вимагає вживання заходів. У нормальних умовах підхожою межею, шо вимагає вживання заходів, є вміст 100 життєздатних аеробних мікроорганізмів в 1 мл. Визначення проводять методом мембранної фільтрації, використовуючи густе живильне середовище S. Інкубацію проводять при температурі від 30 °С до 35 °С протягом 5 діб. Кількість зразка для випробування відбирають залежно від передбачуваного результату. Визначають вміст загального органічного вуглецю: не більше 0,5 мг/л; або проводять випробування "Речовини, що окиснюються" таким чином: до 100 мл субстанції додають 10 мл кислоти сірчаної розведеної, 0,1 мл 0,02 М розчину калію перманганату І кип'ятять протягом 5 хв; розчин має залишатися слабко-рожевим.
Визначають питому електропровідність: не більше 4.3 мкСм-см' при температурі 20 °С.
Воду очишену "in bulk" зберігають і використовують в умовах, що дозволяють запобігти росту мікроорганізмів і уникнути будь-яких інших забруднень.
ВЛАСТИВОСТІ
Прозора, безбарвна рідина без смаку і запаху.
ВИПРОБУВАННЯ НА ЧИСТОТУ
Нітрати. Не більше 0.00002 %. 5 мл субстанції поміщають у пробірку, занурену в льодяну баню, додають 0,4 мл розчину 100 г/л калію хлориду, 0,1 мл розчину дифеніламіну і краплями, при перемішуванні, 5 мл кислоти сірчаної, вільної від азоту. Потім пробірку переносять у водяну баню, нагріту до температури 50 °С; через 15 хв блакитне забарвлення випробовуваного розчину має бути не інтенсивнішим за забарвлення еталона, приготованого паралельно з випробовуваним розчином із використанням суміші 4.5 мл води, вільної від нітратів, 0.5 мл еталонного розчину нітрату.
Алюміній. 10 мкг/л, якщо субстанція призначена для виробництва розчинів для діалізу.
До 400 мл субстанції додають 10 мл ацетатного буферного розчину рН 6,0 і 100 мл води дистильованої. Одержаний розчин має витримувати випробування на алюміній. Як еталон використовують суміш 2 мл еталонного розчину алюмінію, 10 мл ацетатного буферного розчину рН 6,0 і 98 мл води дистильованої. Як компенсаційний розчин використовують суміш 10 мл ацетатного буферного розчину рН 6,0 і 100 мл води дистильованої.
· Визначення домішки алюмінію у лікарських речовинах проводять з хлороформним розчином гідроксихіноліну:
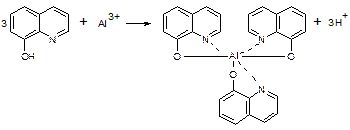
Опалесценція випробовуваного розчину має бути не інтенсивніше за опалесценцію еталону.
Важкі метали (метод А). Не більше 0.00001 % (0.1 ррт). 200 мл субстанції упарюють у скляній випарювальній чашці на водяній бані до об'єму 20 мл 12 мл одержаного розчину мають витримувати випробування на важкі метали. Еталон готують із використанням 10 мл еталонного розчину свинцю.
· Визначення домішки важких металів проводять за методам А взаємодією з тіоацетамідним реактивом за певною методикою в залежності від того, яку природу має досліджувана речовина:
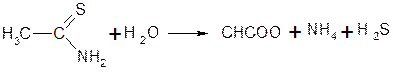
H2S + Pb2+  PbS
PbS 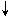 + 2H+
+ 2H+
Коричневе забарвлення випробовуваного розчину має бути не інтенсивніше за забарвлення еталону
Бактеріальні ендотоксини. Менше 0 25 МО/мл, якщо субстанція призначена для виробництва розчинів для діалізу без подальшої процедури видалення бактеріальних ендотоксинів
МАРКУВАННЯ
У необхідних випадках зазначають — субстаншя придатна для виробництва розчинів для діалізу
Вода очищена в контейнерах
Вода очищена в контейнерах — це вода очищена "in bulk", розфасована у підхожі контейнери, яка зберігається в умовах, шо забезпечують мікробіологічну чистоту, що вимагається, і яка не містить ніяких доданих речовин
ВЛАСТИВОСТІ
Прозора, безбарвна рідина без смаку та запаху
ВИПРОБУВАННЯ НАЧИСТОТУ
Вода очищена в контейнерах має витримувати вимоги розділу "Випробування на чистоту" для води очищеної "in bulk", а також випробування, наведені нижче
Кислотність або лужність. До 10 мл субстанції, свіжо-прокип'яченої у пробірці з боросцикатного скла і охолодженої, додають 0,05 мл розчину метилового червоного, одержаний розчин не має забарвлюватися в червоний колір До 10 мл субстанції долають 0,1 мл розчину бромтимолового синього, розчин не має забарвлюватися у синій колір
Речовини, що окиснюються. До 100 мл субстанції додають 10 мл кислоти сірчаної розведеної 0,1 мл 0,02 М розчину калію перманганату і кип'ятять протягом 5 хв, розчин має залишатися слабко-рожевим
Хлориди. До 10 мл субстанції додають 1 мл кислоти азотної розведеної 0,2 мл розчину срібла нітрату, протягом 15 хв не має бути видимих змін розчину
· Визначають за реакцією з розчином аргентуму нітратом у присутності кислоти азотної (р):
Cl - + AgNO3  AgCl
AgCl 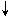 + NO3 -
+ NO3 -
Сульфати. До 10 мл субстанції додають 0 1 мл кислоти хлористоводневої розведеної Р і 0,1 мл розчину барію хлориду Р1, протягом 1 год не має бути видимих змін розчину
· Визначають за реакцією з розчином барію хлориду у присутності кислоти оцтової та еталонного розчину сульфату спиртового:
SO42- + BaCl2  BaSO4
BaSO4 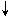
Амонію солі. Не більше 0,00002 %. До 20 мл субстанції додають 1 мл розчину калію тетрайодомеркуратулужного Р, через 5 хв забарвлення одержаного розчину має бути не інтенсивнішим за забарвлення еталона, приготованого одночасно з випробовуваним розчином додаванням 1 мл розчину калію тетрайодомеркурату лужного до суміші 4 мл еталонного розчину амонію 16 мл води, вільної від аміаку.
· визначають за допомогою лужного розчину калію тетрацодмеркурату (реактиву Неслера):
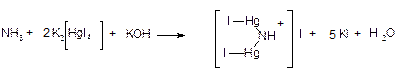
Опалесценція випробовуваного розчину має бути не інтенсивніше за опалесценцію еталону.
Кальцій і магній. До 100 мл субстанції додають 2 мл аміачного буферного розчину рН 10, 0, 50 мг протравного чорного індикаторної суміші і 0,5мл
0,01М розчину натрію едетату, з'являється слабко-синє забарвлення
· виявляють у присутності гідроксиламіну гідро хлориду та аміачного буферного розчину додають індикаторну суміш протравного черного і 0,01М натрію едетату до переходу забарвлення від фіолетового до синього:
Сухий залишок. 100 мл субстанції упарюють насухо на водяній бані та сушать при температурі від 100 °С до 105 °С. Маса сухого залишку не має перевищувати 1мг(0 001%)
Мікробіологічна чистота. Загальне число життєздатних аеробних мікроорганізмів має бути не більше 10- в 1 мл Визначення проводять методом мембранної фільтрації, використовуючи густе живильне середовище В
МАРКУВАННЯ
У необхідних випадках зазначають — субстаншя придатна для виробництва розчинів для діалізу
4. Визначити основні фізичні характеристики лікарських речовин (температуру топлення, кипіння і застигання) фізичними методами. Визначити основні показники готових лікарських засобів отриманих з лікарських та допоміжних речовин, візуальними та інструментальними методами (прозорість, забарвленість, рН, показник заломлення, кут обертання, та густину ін’єкційних розчинів)
На дослідження запропонована субстанція:
Натрію гідрокарбонат (Natrii hydrodenocarbonas) NaHCO3
 2015-04-20
2015-04-20 842
842







