Повышение температуры ускоряет большинство химических реакций. Согласно правилу Вант-Гоффа при повышении температуры на каждые 100С скорость реакций увеличивается в 2-4 раза.
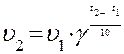 , (2)
, (2)
где 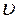 2 и
2 и 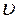 1 – скорости реакций, соответствующих температуре t2 и t1;
1 – скорости реакций, соответствующих температуре t2 и t1;
g - постоянное для данной реакции число, называемое температурным коэффициентом скорости реакции. Для большинства реакций g имеет значение от 2 до 4.
Более точно влияние температуры на скорость реакции описывается уравнением Аррениуса:
k = k0e (-Eaкт/RT), (3)
где k – константа скорости реакции;
k0 – предэкспоненциальный множитель, отражает частоту столкновений и ориентацию реагирующих частиц (частотный фактор Аррениуса);
e – основание натурального логарифма;
Eaкт – постоянная, называемая энергией активации, определяемая природой реакции. Значения Eaкт для химических реакций лежат в пределах 40 - 400 кДж/моль.
 2015-04-20
2015-04-20 490
490








