Изучение зависимости скоростей химических реакций от различных факторов имеет большое практическое значение, потому что помогает управлять ими, но информация о реакции не будет полной без рассмотрения состояния химического равновесия, которое является составной частью термодинамики, и его количественной характеристики - константы равновесия.
При протекании химической реакции концентрации исходных веществ уменьшаются; в соответствии с законом действия масс это приводит к уменьшению скорости реакции. Если реакция обратима, то есть может протекать как в прямом, так и в обратном направлениях, то с течением времени скорость обратной реакции будет возрастать, так как увеличиваются концентрации продуктов реакции. Когда скорости прямой 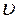 ® и обратной реакций
® и обратной реакций 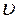 становятся одинаковыми, наступает состояние химического равновесия, и дальнейшего изменения концентраций участвующих в реакции веществ не происходит. Гомогенное равновесие: реагенты находятся в одной фазе (газовой или жидкой). Гетерогенное равновесие: реагенты находятся в разных фазах.
становятся одинаковыми, наступает состояние химического равновесия, и дальнейшего изменения концентраций участвующих в реакции веществ не происходит. Гомогенное равновесие: реагенты находятся в одной фазе (газовой или жидкой). Гетерогенное равновесие: реагенты находятся в разных фазах.
В случае обратимой химической реакции:
аA + bB  ® cC + dD.
® cC + dD.
Зависимость скоростей прямой (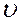 ®) и обратной (
®) и обратной (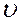 ) реакций от концентраций реагирующих веществ выражается соотношениями:
) реакций от концентраций реагирующих веществ выражается соотношениями:
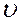 ® = k® [A]a [B]b;
® = k® [A]a [B]b;
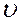 = k [C]c [D]d,
= k [C]c [D]d,
где [A], [B], [C], [D] – равновесные концентрации соответствующих веществ.
В состоянии химического равновесия 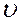 ®=
®= 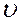 , то есть k®[A]a[B]b=k[C]c[D]d. Отсюда:
, то есть k®[A]a[B]b=k[C]c[D]d. Отсюда:
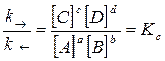 , (4)
, (4)
где Кс – константа равновесия, выраженная через концентрации реагентов и продуктов реакции.
В выражение константы равновесия гетерогенной реакции входят только концентрации веществ, находящихся в жидкой или газовой фазе, так как концентрации твердых веществ остаются постоянными.
Катализатор не влияет на значение константы равновесия, поскольку он снижает энергию активации прямой и обратной реакций на одну и ту же величину и поэтому одинаково изменяет скорости прямой и обратной реакций. Катализатор лишь ускоряет достижение равновесия, он не влияет на количественный выход продуктов реакции.
При изменении условий протекания реакций (температуры, давления, концентрации какого-либо из участвующих в реакции веществ) скорости прямого и обратного процессов изменяются неодинаково, и химическое равновесие нарушается. В результате устанавливается новое химическое равновесие, отличающееся от исходного. Процесс перехода от одного равновесного состояния к новому равновесию называется смещением химического равновесия. Направление этого смещения подчиняется принципу Ле Шателье-Брауна:
Если на систему, находящуюся в состоянии химического равновесия, оказать какое-либо воздействие, то равновесие сместится в сторону уменьшения этого воздействия:
1) при повышении давления равновесие смещается в сторону уменьшения числа молей газообразных веществ; при понижении давления - в сторону увеличения числа молей газообразных веществ;
2) при повышении температуры равновесие смещается в сторону эндотермической реакции; при понижении температуры - в сторону экзотермической реакции;
3) при увеличении концентрации одного из реагентов равновесие смещается в сторону расхода этого реагенте; при уменьшении концентрации - в сторону образования этого реагента.
 2015-04-20
2015-04-20 4386
4386
