Чтобы произошла реакция, необходимо столкновение реагирующих частиц. При одной и той же температуре число столкновений растет с увеличением числа реагирующих частиц в единице объема, то есть с возрастанием концентрации реагентов. Соответственно скорость реакции повышается с увеличением концентраций реагирующих веществ. Скорость реакции:
aA + bB ® eE + fF
равна 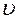 = k CaA × CbB., (1)
= k CaA × CbB., (1)
где k – константа скорости реакции;
a и b – стехиометрические коэффициенты веществ А и В в уравнении реакции.
Уравнение (1) называется законом действующих масс (К.М. Гульберг, Г. Вааге 1864-1867 гг.): Скорость химической реакции при данной температуре прямо пропорциональна произведению концентраций реагирующих веществ в степенях с показателями, равными стехиометрическим коэффициентам в уравнении реакции.
Константа скорости реакции k не зависит от концентрации реагентов, но зависит от их природы, температуры и присутствия катализатора. Константа скорости реакции численно равна самой скорости реакции, если концентрации всех реагирующих веществ равны 1 моль/л.
При гетерогенных реакциях концентрации веществ, находящихся в твердой фазе, обычно незначительно изменяются в ходе реакции и поэтому не включаются в уравнение закона действующих масс.
 2015-04-20
2015-04-20 405
405








