Содержание растворенного вещества в растворе может быть выражено либо безразмерными единицами – долями или процентами, либо величинами размерными – концентрациями. Наиболее часто употребляемыми в химии способами выражения содержания растворенного вещества в растворе являются: массовая и мольная доли, молярная, эквивалентная и моляльная концентрации, а также титр раствора.
1) Массовая доля – это соотношение массы растворенноговещества к массе раствора, выраженное в долях или процентах, показывает число граммов растворенного вещества в 100 г раствора.
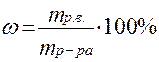 ,
,
где mр.в - масса растворенного вещества, г;
m р-ра – масса раствора,г;
m р-ра = m р-ля + mр.в ,
где m р-ля - масса растворителя, г.
2) Мольная доля - это отношение числа молей растворенного вещества (или растворителя) к сумме числа молей растворенного вещества и растворителя.
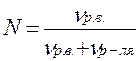 ,
,
где νр.в. - число молей растворенного вещества, моль;
νр-ля. - число молей растворителя, моль.
3) Молярная концентрация (молярность) – это отношение количества растворенного вещества к объему раствора, показывает число молей растворенного вещества в 1 литре раствора.
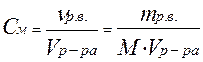 ; моль/л
; моль/л
где М - молярная масса растворенного вещества, г/моль;
VР-РА – объем раствора, л;
4) Эквивалентная или нормальная концентрация (нормальность) – отношение числа эквивалентов растворенного вещества к объему раствора, показывает число эквивалентов растворенного вещества в 1 литре раствора.
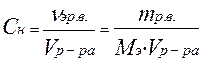 ; моль/л
; моль/л
где МЭ - эквивалентная масса растворенного вещества, г/моль;
νэр.в. - число эквивалентов растворенного вещества, моль;
5) Моляльная концентрация (моляльность) – это отношение количества растворенного вещества к массе растворителя, показывает сколько молей растворенного вещества содержится в 1 кг растворителя.
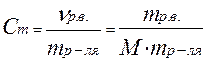 ; моль/кг
; моль/кг
6) Титр – это масса растворенного вещества, приходящаяся на 1 мл раствора.

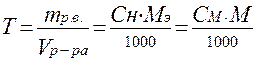 ; г/мл
; г/мл
 2015-04-20
2015-04-20 2174
2174
