В конце XIX века Рауль, Вант-Гофф, Аррениус установили весьма важные закономерности, связывающие концентрацию раствора с давлением насыщенного пара растворителя над раствором, температурой кипения и замерзания, осмотическим давлением. Перечисленные свойства относят к общим свойствам раствора, которые зависят от концентрации и не зависят от природы растворенного вещества. Законы Рауля и Вант-Гоффа справедливы для сильно разбавленных растворов неэлектролитов (мольная доля растворенного вещества Nв << 0,005 или молярная концентрация C < 0,5 моль/дм3).
Растворы, которые подчиняются этим законом, получили название идеальных растворов. Теория идеальных растворов в настоящее время хорошо разработана. Она отличается простотой, поскольку базируется на том условии, что компоненты идеального раствора не взаимодействуют друг с другом, т.е. идеальные растворы ведут себя как идеальные газы и, следовательно, подчиняются законам идеальных газов.
Рассмотрим законы идеальных растворов неэлектролитов.
Первый закон Рауля (1887): относительное понижение давления насыщенного пара растворителя над раствором нелетучего неэлектролита равно мольной доле растворенного вещества в растворе:
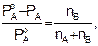 (7.8)
(7.8)
где РАо – давление насыщенного пара над чистым растворителем, Па; РА – давление насыщенного пара над раствором, Па; nВ – число молей растворенного вещества; nА – число молей растворителя.
Как видно из уравнения (7.8), относительное понижение давления пара для данного раствора не зависят от природы растворенного вещества и растворителя, а также от температуры. Оно зависит лишь от концентрации раствора. Причем давление насыщенного пара над чистым растворителем всегда больше, чем давление насыщенного пара над раствором (РАо > РА), это связано с тем, что испарение идет с поверхностного слоя. У чистого растворителя на поверхности находятся только молекулы растворителя, а в растворе в поверхностном слое находятся еще и молекулы растворенного вещества, понижая содержание молекул растворителя; также растворенные частицы сольватированы (гидратированы), что затрудняет переход молекул растворителя в пар.
Второй закон Рауля: абсолютное понижение температуры замерзания или абсолютное повышение температуры кипения разбавленных растворов неэлектролитов прямо пропорционально его моляльной концентрации.
Dtз = EкСm и Dtк = EэСm, (7.9)
где Dtз – абсолютное понижение температуры замерзания раствора, оС; Eк – криоскопическая постоянная, кгК/моль; Сm – моляльная концентрация раствора, моль/кг; Dtк – абсолютное повышение температуры кипения раствора, оС; Eэ – эбулиоскопическая постоянная, кгК/моль.
Dtз = tз р-ля – t з р-ра; Dtк = tk р-ра – tk р-ля, (7.10)
где tз р-ля – температура замерзания растворителя, оС; tз р-ра – температура замерзания раствора, оС; tk р-ра – температура кипения раствора, оС; tk р-ля – температура кипения растворителя, оС.
Криоскопическая постоянная показывает абсолютное понижение температуры замерзания раствора неэлектролита, который в одном кг растворителя содержит один моль растворенного вещества. Для воды Ек = 1,86 кгК/моль, следовательно, раствор 1 моля неэлектролита в 1 кг воды замерзает при температуре -1,86 оС.
Эбулиоскопическая постоянная показывает абсолютное повышение температуры кипения раствора неэлектролита, который в одном кг растворителя содержит 1 моль растворенного вещества. Для воды Eэ = 0,52 кгК/моль, следовательно, раствор 1 моля неэлектролита в 1 кг воды кипит при 100,52 оС. Уравнения (7.9) и (7.10) используют для определения молярной массы вещества.
Закон Вант-Гоффа: осмотическое давление растворенного вещества в разбавленном растворе равно тому газовому давлению, которое производило бы это вещество, если бы оно в виде газа при той же температуре, занимало бы тот же объем, что и раствор.
Для осмотического давления можно применить уравнение состояние идеального газа
pV = nRT или p = nRT/V.
 2014-02-12
2014-02-12 1494
1494
