Реакции первого порядка.
Рассмотрим в общем виде реакцию первого порядка:
А  продукты
продукты
Уравнение скорости для этого типа реакций имеет вид:
ω = - 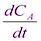 = kCА
= kCА
После разделения переменных получим:
- 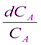 = kdt
= kdt
Интегрирование уравнения в пределах С0 – С и 0 – t даёт:
ln 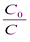 = kt
= kt
где С0 – концентрация вещества А на начало реакции при t = 0;
С - концентрация вещества А ко времени протекания реакции t;
k –константа скорости химической реакции.
Это уравнение часто используется в виде
lnC = lnC0 – kt
Реакции второго порядка
Рассмотрим в общем виде реакцию второго порядка типа
А + В  продукты
продукты
Уравнение скорости дя реакций подобного типа можно записать в виде
ω = - 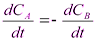 = kCACB
= kCACB 
Если начальные концентрации (t = 0) веществ А и В одинаковы и равны С0,А = С0,В = С0, то:
ω = - 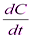 = kC2,
= kC2,
где С – концентрация вещества А и В ко времени t.
После разделения переменных и интегрирования в пределах С0 – С и 0 – t получим:
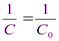 + kt
+ kt
или
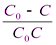 = kt
= kt
Период полураспада для реакций подобного типа определяется уравнением:
t1/2 = 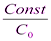
Рассмотрим в общем виде реакцию третьего порядка:
3А  продукты
продукты
Уравнение скорости для этого типа реакций имеет вид:
ω = - 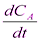 = kC
= kC 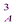
После разделения переменных получим:
- 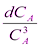 = kdt
= kdt
Интегрирование уравнения в пределах С0 – С и 0 – t даёт:
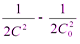 = kt
= kt
или 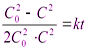
где С0 – концентрация вещества А на начало реакции при t = 0;
С - концентрация вещества А ко времени протекания реакции t;
k –константа скорости химической реакции.
 2015-04-20
2015-04-20 3969
3969
