Опыт 1. Зависимость скорости реакции от природы реагирующих веществ.
Подготовьте прибор для собирания газа над водой. В стеклянный кристаллизатор налейте воды; коническую пробирку доверху заполните водой. Закрыв отверстие пробирки пальцем, переверните её вверх дном и опустите в кристаллизатор с водой. Под водой осторожно откройте пробирку. Укрепите в штативе вторую пробирку, налейте в неё ¾ объёма 0,1 М раствора уксусной кислоты. Промойте водой 2–3 маленьких кусочка цинка, вытрите их фильтровальной бумагой и опустите в пробирку с кислотой. Пробирку закройте пробкой с отводной трубкой, конец которой опустите в воду и подведите под пробирку. Запишите время заполнения пробирки газом.
По окончании опыта вылейте уксусную кислоту из микроколбы, промойте цинк и высушите его фильтровальной бумагой.
Проведите аналогичный опыт, налив в колбу 0,1 М раствор соляной кислоты. Запишите время заполнения пробирки газом в этом случае.
Напишите уравнения реакции взаимодействия цинка с уксусной и соляной кислотами. Чем объяснить различную скорость выделения водорода в первом и во втором случаях?
Опыт 2. Зависимость скорости реакции от концентрации реагирующих веществ.
В три большие пробирки (или стаканчика) наливайте по 10 мл раствора Na2SO3, подкисленного H2SO4 и содержащего небольшое количество крахмала, а в три других: в первую – 10 мл раствора KIO3 + 20 мл H2O, во вторую – 20 мл раствора KIO3 + 10 мл Н2О и в третью – 30 мл KIO3.
Реакция между указанными веществами в сернокислой среде протекает по уравнению:
KIO3 + 5 Na2SO3 + H2SO4 = I2 + 5 Na2SO4 + K2SO4 + H2O.
Слейте по очереди попарно растворы Na2SO3 и KIO3. Отметьте время появления окраски раствора по секундомеру в каждой пробирке. Результаты опыта запишите в таблицу:
| № проб | Объём, мл | Общий объём, мл | Относит. концентрация | Время потемнения | Относит. скорость реакции | ||
| Na2SO3 | KIO3 | H2O | |||||
На миллиметровой бумаге постройте кривую зависимости скорости реакции от концентрации KIO3 (в относительных единицах).
Опыт 3. Зависимость скорости реакции от температуры.
Зависимость скорости реакции от температуры изучают на примере реакции
Na2S2O3 + H2SO4 = Na2SO4 + SO2 + H2O
По правилу Вант-Гоффа (при γ = 1,8).
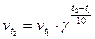
получаем, что при повышении температуры на 100 скорость реакции увеличивается на 1,8 раза, на 200 – в 3,24 раза, на 300 – в 5,832 раза и т.д.
В три пробирки налейте по 5 мл раствора Na2S2O3. Поместите все пробирки в стакан с водой и через 5-7 мин., измерив температуру воды в стакане, смешайте содержимое одной пары пробирок с H2SO4 и Na2S2O3, и определите время помутнения раствора по секундомеру с момента сливания до начала появления мути.
Стаканчик с оставшимися пробирками подогрейте на 100 и, вновь выдержав растворы при этой температуре 5 - 7мин, слейте содержимое второй пары пробирок с H2SO4 и Na2S2O3. Определите время до начала появления мути.
Стаканчик с оставшимися пробирками подогрейте на 100 и, вновь выдержав растворы при этой температуре 5 - 7мин (температура должна быть выше первоначальной на 20 0С), слейте содержимое последней пары пробирок с H2SO4 и Na2S2O3. Определите время до начала появления мути.
Результаты опыта запишите в таблицу.
| № пробирки | Температура, 0С | Время появления мути | Относит. скорость реакции | |
| vтеор. | vпракт. | |||
| 1,8 | ||||
| 3,24 |
На миллиметровой бумаге постройте кривую зависимости vтеор . от температуры. На этом же графике отметьте рассчитанные заранее значения vпракт .
Рассчитайте значения температурного коэффициента γпракт . исходя из опытных данных.
Сделайте выводы о зависимости скорости реакции от температуры.
Опыт 4. Влияние поверхности раздела реагирующих веществ на скорость реакции в гетерогенной системе.
1.Взаимодействие карбоната кальция с соляной кислотой.
Приготовьте два небольших приблизительно одинаковых кусочка мела. Один из них разотрите пестиком на листе бумаги и пересыпьте в коническую пробирку, второй поместите в другую пробирку. В обе пробирки одновременно добавьте по 15 - 20 капель концентрированной соляной кислоты. Напишите уравнение реакции. Отметьте наблюдаемые явления и объясните их.
2. Взаимодействие нитрата свинца с йодидом калия.
Несколько кристаллов йодида калия и нитрата свинца Pb(NO3)2 поместите раздельно в две сухие чистые ступки, и тщательно разотрите пестиком. Приготовьте две сухие конические пробирки. В одну из них положите по несколько кристаллов Pb(NO3)2 и KI, в другую насыпьте приблизительно такое же количество солей, растёртых в порошок. Для перемешивания реагирующих веществ обе пробирки несколько раз энергично встряхните, закрыв отверстие пальцем. Поставьте пробирки в штатив и наблюдайте образование йодида свинца.
Отметьте влияние поверхности соприкосновения реагирующих веществ на скорость химической реакции. Запишите уравнение реакции обмена между йодидом калия и нитратом свинца.
Опыт 5. Гомогенный катализ.
1. Каталитическое уравнение реакции разложения пероксида водорода.
Налейте в пробирку 10 мл 3 %-ного раствора пероксида водорода. Опустите в пробирку тлеющую лучину, не касаясь раствора. Объясните, почему лучина не вспыхивает?
В коническую колбу налейте 10 мл 0,01 М раствора молибдата натрия Na2MoO4 и затем, постепенно, из пробирки прилейте 10 мл пероксида водорода.
Наблюдайте изменение окраски раствора и момент начала выделения пузырьков кислорода. Для завершения реакции смесь слегка нагрейте. Убедитесь в наличии кислорода в колбе при помощи тлеющей лучины.
Объясните наблюдение, приняв во внимание следующие реакции между молибдатом натрия и пероксидом водорода:
4 H2O2 + Na2MoO4 → Na2MoO8 + 4 H2O,
Na2MoO8 → Na2MoO4 + 2 O2
В конечном счёте:
2 H2O2 → 2 H2O + 2 O2.
Какую роль играет молибдат натрия?
2. Каталитическое ускорение окисления марганца.
Окисление соединений марганца (II) до марганца (VII) в растворе легко наблюдать, так как ион Mn2+ практически бесцветный, а ион MnO4- окрашен в фиолетово-красный цвет.
Внесите в две пробирки по 3-4 капли сульфата MnSO4 или нитрата Mn(NO3)2 марганца и подкислите таким же объёмом раствора азотной кислоты. В одну из пробирок добавьте одну каплю раствора нитрата серебра AgNO3 и в обе пробирки по одному микрошпателю пероксодисульфата аммония (NH4)2S2O8.
Поместите обе пробирки в водяную баню. В какой пробирке быстрее изменится окраска? Реакция протекала по уравнению.
2 MnSO4 + 5 (NH4)2S2O8 + 8 H2O = 2 HМnO4 + 5 (NH4)2SO4 + 7 H2SO4.
Азотная кислота в реакции не расходовалась, добавлялась для создания определённой кислотности среды в начале реакции. В качестве промежуточных быстро протекающих процессов происходило восстановление иона серебра марганцем (II) и обратное окисление серебра пероксодисульфатом аммония. Какой ион является катализатором в данном процессе?
Опыт 6. Гетерогенный катализ.
Каталитическое действие диоксида свинца на разложение пероксида водорода. Налейте в пробирку 5 - 8 капель 30%-ного раствора пероксида водорода. С помощью тлеющей лучины убедитесь в отсутствии кислорода. Внесите в раствор на кончике микрошпателя диоксид свинца PbO2 и наблюдайте выделение газа. Напишите уравнение разложения пероксида водорода (диоксид свинца можно заменить диоксидом марганца MnO2).
Вопросы и задачи.
1. Что называется скоростью химической реакции? От каких факторов она зависит?
2. Как и почему изменяется скорость химической реакции при изменении температуры?
3. Что называют энергией активации?
4. От каких факторов зависит скорость химической реакции в гетерогенной системе?
5. Как изменится скорость реакции: 2NO + O2 → 2NO2.
а) при увеличении концентрации NO в два раза;
б) при одновременном увеличении концентрации NO и O2 (каждой в 3 раза)?
6. Реакция между веществами А и В выражается уравнением А + 2 В = С. Начальная концентрация вещества А равна 0,3 моль/л, а вещества В = 0,5 моль/л, К = 0,4. Чему равна скорость реакции в начальный момент и по истечении времени, когда концентрация вещества А уменьшится на 0,1 моль?
7. Скорость реакции А + 2 В = С (при [А] = 0,5 моль/л и [В] = 0,6 моль/л) найдена равной 0,016. Определить К.
8. Как зависит скорость реакции от температуры?
9. Что показывает температурный коэффициент скорости реакции?
10. Две реакции при 283 К протекают с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2,5, второй – 3,0. Как будут относиться скорости реакций, если первую из них провести при 350 К, а вторую – при 330 К?
11. На сколько нужно повысить температуру, чтобы скорость реакции возросла в 90 раз, если температурный коэффициент равен 2,7?
12. При повышении температуры на 60 0С скорость реакции увеличилась в 4000 раз. Вычислить температурный коэффициент.
13. Скорость химической реакции возросла в 124 раза, температурный коэффициент реакции равен 2,8. На сколько градусов была повышена температура?
14. При температуре 353 К реагирует 1 моль вещества в минуту. Сколько молей вещества прореагирует за тот же промежуток времени, если температура будет увеличена до 393 и до 453 К (температурный коэффициент скорости реакции равен 2)?
Работа №5
 2015-01-07
2015-01-07 2130
2130
